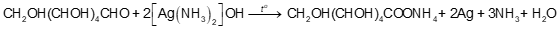Bài 4. Giới thiệu về carbohydrate. Glucose và fructose trang 20, 21, 22 Hóa 12 Kết nối tri thức
Carbohydrate gồm nhiều hợp chất thiên nhiên có
CH tr 20 MĐ
Trả lời câu hỏi Mở đầu trang 20 SGK Hóa 12 Chân trời sáng tạo
Carbohydrate gồm nhiều hợp chất thiên nhiên có vai trò quan trọng đối với sinh vật như: tinh bột và glucose là nguồn dự trữ và cung cấp năng lượng quan trọng cho các quá trình sinh hoá tế bào; cellulose giúp xây dựng cấu trúc cho màng tế bào thực vật và thân cây. Vậy, carbohydrate là gì? Các carbohydrate đơn giản như glucose và fructose có các tính chất hoá học cơ bản nào?
Phương pháp giải:
Nêu khái niệm carbohydrate.
Nêu tính chất hóa học của glucose và fructose
Lời giải chi tiết:
- Carbohydrate là những hợp chất hữu cơ tạp chức, thường có công thức chung là C n (H 2 O) m .
- Tính chất hóa học:
+ Glucose có tính chất hóa học của polyalcohol và aldehyde.
+ Fructose có tính chất hóa học của polyalcohol và ketone.
CH tr 20 HĐ1
Trả lời câu hỏi Hoạt động 1 trang 20 SGK Hóa 12 Chân trời sáng tạo
Xét công thức cấu tạo mạch hở của hai carbohydrate sau:
CH 2 OH-CHOH-CHOH-CHOH-CHOH-CH=O;
CH 2 OH-CHOH-CHOH-CHOH-CO-CH 2 OH.
Hai carbohydrate trên chứa những loại nhóm chức nào?
Phương pháp giải:
-OH: nhóm chức alcohol.
>C=O: nhóm chức ketone.
-CH=O: nhóm chức aldehyde.
Lời giải chi tiết:
|
Công thức cấu tạo |
Loại nhóm chức |
|
CH 2 OH-CHOH-CHOH-CHOH-CHOH-CH=O |
Alcohol (-OH); Aldehyde (-CH=O). |
|
CH 2 OH-CHOH-CHOH-CHOH-CO-CH 2 OH |
Alcohol (-OH); Ketone (>C=O). |
CH tr 20 HĐ2
Trả lời câu hỏi Hoạt động 2 trang 20 SGK Hóa 12 Chân trời sáng tạo
Công thức phân tử của một số carbohydrate là C 6 H 12 O 6 , C 12 H 22 O 11 và (C 6 H 10 O 5 ) n . Viết lại các công thức này dưới dạng C n (H 2 O) m .
Phương pháp giải:
n = số C trong công thức phân tử.
m = số O trong công thức phân tử hoặc \(\frac{1}{2}\)số H
Lời giải chi tiết:
|
Công thức phân tử |
Công thức dạng C n (H 2 O) m |
|
C 6 H 12 O 6 |
C 6 (H 2 O) 6 |
|
C 12 H 22 O 11 |
C 12 (H 2 O) 11 |
|
(C 6 H 10 O 5 ) n |
(C 6 (H 2 O) 5 ) n |
CH tr 22 HĐ
Trả lời câu hỏi Hoạt động 1 trang 22 SGK Hóa 12 Chân trời sáng tạo
Từ cấu tạo phân tử của glucose và fructose (dạng mạch hở và mạch vòng), cho biết mỗi chất chứa các nhóm chức nào và đề xuất một số phản ứng chứng minh sự tồn tại của các nhóm chức đó.
Phương pháp giải:
- Glucose có tính chất hóa học của polyalcohol và aldehyde.
Fructose có tính chất hóa học của polyalcohol và ketone.
- Các polyalcohol có các nhóm –OH liền kề như ethylene glycol, glycerol, ... có thể tạo phức chất với Cu(OH) 2 , sản phẩm có màu xanh đặc trưng.
Aldehyde có phản ứng với thuốc thử Tollens.
Ketone no không làm mất màu nước bromine.
Lời giải chi tiết:
- Glucose chứa 5 nhóm chức –OH kề nhau và 1 nhóm chức –CHO.
Fructose chứa 5 nhóm chức –OH và 1 nhóm chức >CO.
- Một số phản ứng chứng minh sự tồn tại của các nhóm chức:
+ Để chứng minh sự tồn tại của polyalcohol, ta cho glucose (frutose) phản ứng với Cu(OH) 2 , Cu(OH) 2 tan chứng tỏ trong phân tử của glucose (fructose) có các nhóm –OH kề nhau.
+ Để chứng minh sự tồn tại của nhóm chức aldehyde, ta cho glucose phản ứng với thuốc thử Tollens, nếu cho ra được kết tủa bạc, chứng tỏ trong phân tử glucose có –CHO.
+ Cho fructose vào ống nghiệm chứa nước bromine, nước bromine không mất màu, chứng tỏ trong phân tử fructose không có nhóm chức aldehyde hoặc liên kết bội, do đó fructose có nhóm chức >C=O.
CH tr 22 HĐ2
Trả lời câu hỏi Hoạt động 2 trang 22 SGK Hóa 12 Chân trời sáng tạo
Thí nghiệm: Phản ứng của glucose với Cu(OH) 2
Chuẩn bị:
Hoá chất dung dịch CuSO 4 5%, dung dịch NaOH 10%, dung dịch glucose 2%.
Dụng cụ: ống nghiệm.
Tiến hành:
Cho khoảng 2 mL dung dịch NaOH 10% vào ống nghiệm. Sau đó, thêm khoảng 0,5 mL dung dịch CuSO 4 5% vào, lắc nhẹ.
Cho tiếp khoảng 3 mL dung dịch glucose 2% vào ống nghiệm và lắc đều.
Quan sát hiện tượng xảy ra, giải thích và viết phương trình hoá học.
Phương pháp giải:
Phân tử glucose và fructose có nhiều nhóm hydroxy liền kề nên dung dịch glucose và dung dịch fructose có thể hoà tan copper(II) hydroxide trong môi trường kiềm, tạo thành dung dịch có màu xanh lam.
\(2{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}} + {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \to {{\rm{(}}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{11}}}}{{\rm{O}}_{\rm{6}}}{\rm{)}}_{\rm{2}}}{\rm{Cu}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Lời giải chi tiết:
- Hiện tượng:
+ Khi nhỏ dung dịch CuSO 4 vào dung dịch NaOH, xuất hiện kết tủa màu xanh lam.
+ Nhỏ dung dịch glucose vào ống nghiệm chứa kết tủa, lắc đều, kết tủa tan.
- Giải thích:
+ Kết tủa màu xanh lam thu được khi nhỏ dung dịch CuSO 4 vào dung dịch NaOH là Cu(OH) 2 .
\({\rm{CuS}}{{\rm{O}}_{\rm{4}}} + 2{\rm{NaOH}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
+ Nhỏ dung dịch glucose vào ống nghiệm chứa kết tủa, lắc đều, kết tủa tan vì glucose hoà tan copper(II) hydroxide tạo thành dung dịch có màu xanh lam.
\(2{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}} + {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \to {{\rm{(}}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{11}}}}{{\rm{O}}_{\rm{6}}}{\rm{)}}_{\rm{2}}}{\rm{Cu}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
CH tr23 HĐ
Trả lời câu hỏi Hoạt động trang 23 SGK Hóa 12 Chân trời sáng tạo
Thí nghiệm: Tính chất aldehyde của glucose
Chuẩn bị :
Hoá chất: dung dịch CuSO 4 5%, dung dịch NaOH 10%, dung dịch AgNO 3 1%, dung dịch ammonia 5%, nước bromine loãng, dung dịch glucose 2%, nước nóng.
Dụng cụ: ống nghiệm, cốc thuỷ tinh, đèn cồn.
Tiến hành:
1. Oxi hoá glucose bằng Cu(OH) 2
- Cho khoảng 2 mL dung dịch NaOH 10% vào ống nghiệm. Sau đó, thêm khoảng 0,5 mL dung dịch CuSO 4 5% vào, lắc nhẹ.
- Cho tiếp khoảng 3 mL dung dịch glucose 2% vào ống nghiệm và lắc đều.
- Đun nóng ống nghiệm bằng ngọn lửa đèn cồn trong vài phút.
2. Phản ứng của glucose với thuốc thử Tollens
- Cho khoảng 2 mL dung dịch AgNO 3 1% vào ống nghiệm, thêm từ từ dung dịch ammonia 5%, lắc đều đến khi kết tủa tan hết. Dung dịch thu được là thuốc thử Tollens.
- Thêm vào ống nghiệm khoảng 2 mL dung dịch glucose 2%, lắc đều. Sau đó, ngâm ống nghiệm vào cốc thuỷ tinh chứa nước nóng trong vài phút.
3. Phản ứng của glucose với nước bromine
- Cho khoảng 1 mL nước bromine loãng vào ống nghiệm.
- Thêm tiếp từ từ 2 mL dung dịch glucose 2%, lắc đều.
Quan sát và mô tả hiện tượng xảy ra trong mỗi ống nghiệm, giải thích và viết phương trình hoá học.
Phương pháp giải:
Lời giải chi tiết:
|
Hiện tượng |
Giải thích hiện tượng và phương trình hóa học |
|
Khi nhỏ dung dịch CuSO 4 vào dung dịch NaOH, xuất hiện kết tủa màu xanh lam. |
Kết tủa màu xanh lam thu được là Cu(OH) 2 . \({\rm{CuS}}{{\rm{O}}_{\rm{4}}} + 2{\rm{NaOH}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} + {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\) |
|
Nhỏ dung dịch glucose vào ống nghiệm chứa kết tủa, lắc đều, kết tủa tan. |
Kết tủa tan vì glucose hoà tan copper(II) hydroxide tạo thành dung dịch có màu xanh lam. \(2{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}} + {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \to {{\rm{(}}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{11}}}}{{\rm{O}}_{\rm{6}}}{\rm{)}}_{\rm{2}}}{\rm{Cu}} + 2{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
|
Khi đun nóng ống nghiệm, xuất hiện kết tủa màu đỏ gạch. |
Glucose phản ứng với Cu(OH) 2 trong môi trường base khi đun nóng tạo kết tủa màu đỏ gạch.
|
2. Phản ứng của glucose với thuốc thử Tollens
|
Hiện tượng |
Giải thích hiện tượng và phương trình hóa học |
|
Cho dung dịch AgNO 3 vào ống nghiệm, thêm từ từ dung dịch ammonia, lắc đều kết tủa tan hết. |
- Khi cho dung dịch AgNO 3 và dung dịch NH 3 thì xuất hiện kết tủa xám silver oxide: 2AgNO 3 + 2NH 3 + H 2 O → Ag 2 O + 2NH 4 NO 3 - Tiếp tục nhỏ từ từ dung dịch NH 3 vào ống nghiệm, kết tủa tan: Ag 2 O + H 2 O + 4NH 3 → 2[Ag(NH 3 ) 2 ]OH |
|
Có sự tạo thành kết tủa trắng bạc bám trên thành ống nghiệm. |
Glucose phản ứng với dung dịch AgNO 3 /NH 3 tạo thành kết tủa Ag màu trắng bạc.
|
3. Phản ứng của glucose với nước bromine
|
Hiện tượng |
Giải thích hiện tượng và phương trình hóa học |
|
Nước bromine bị mất màu. |
Glucose có nhóm chức –CHO, bromine oxi hóa glucose, phản ứng xảy ra làm nước bromine mất màu. \({\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH(CHOH}}{{\rm{)}}_{\rm{4}}}{\rm{CHO + B}}{{\rm{r}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{OH(CHOH}}{{\rm{)}}_{\rm{4}}}{\rm{COOH + 2HBr}}\) |
CH tr 23 CH
Trả lời câu hỏi trang 23 SGK Hóa 12 Chân trời sáng tạo
Viết phương trình hoá học minh hoạ phản ứng của fructose với thuốc thử Tollens và Cu(OH) 2 (trong môi trường kiềm, đun nóng).
Phương pháp giải:
Tuy không có nhóm -CHO trong phân tử, nhưng trong môi trường kiềm, fructose chuyển hoá thành glucose, nên có phản ứng với thuốc thử Tollens tương tự glucose.
Lời giải chi tiết:
- Trong môi trường kiềm, fructose chuyển hoá thành glucose:
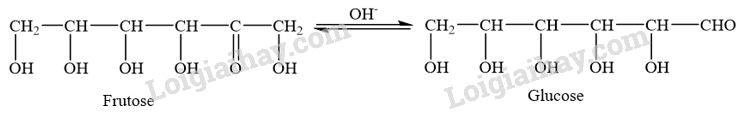
- Sau đó, glucose phản ứng với thuốc thử Tollens và Cu(OH) 2 (trong môi trường kiềm, đun nóng):

CH tr 24
Trả lời câu hỏi trang 24 SGK Hóa 12 Chân trời sáng tạo
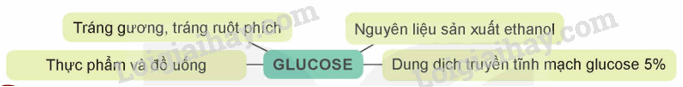
Cho biết các ứng dụng của glucose trong sơ đồ trên dựa trên tính chất nào của chất này.
Phương pháp giải:
- Glucose có khả năng tham gia phản ứng tráng bạc.
- Dưới tác dụng của enzyme, glucose lên men tạo ethanol.
- Glucose là nguồn dinh dưỡng có giá trị cho con người và được ứng dụng nhiều trong ngành công nghiệp thực phẩm, y tế.
Lời giải chi tiết:
- Glucose có nhóm –CHO, do đó glucose có khả năng tham gia phản ứng tráng bạc nên được sử dụng để tráng gương và ruột phích.
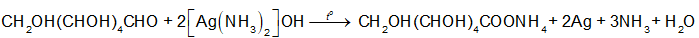
- Glucose có phản ứng lên men tạo ethanol, do đó glucose là nguyên liệu để sản xuất ethanol.
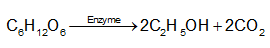
- Glucose có vị ngọt, là nguồn năng lượng cho cơ thể trong quá trình hô hấp tế bào, do đó glucose được sử dụng trong thực phẩm và đồ uống.
- Glucose là chất dinh dưỡng có giá trị đối với con người do có thể hấp thụ trực tiếp vào máu để đi đến các mô và tế bào của cơ thể, nên dung dịch glucose 5% được dùng làm dung dịch truyền tĩnh mạch.