Cho phản ứng sau:
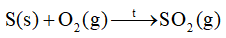 \({\Delta _f}H_{298}^o(S{O_2},g) = - 296,8kJ/mol\)
\({\Delta _f}H_{298}^o(S{O_2},g) = - 296,8kJ/mol\)
Cho khẳng định sau:
a) \({\Delta _f}H_{298}^o(S{O_2},g) = - 296,8kJ/mol\)là lượng nhiệt tỏa ra khi tạo ra 1 mol SO 2 (g) từ đơn chất S (s) và O 2 (g), đây là đơn chất bền nhất ở điều kiện chuẩn.
b) Ở điều kiện chuẩn \({\Delta _f}H_{298}^o({O_2},g) \ne 0\)
c) Ở điều kiện chuẩn \({\Delta _f}H_{298}^o(S,g) = 0\)
d) Hợp chất SO 2 (g) kém bền hơn về mặt năng lượng so với các đơn chất bền S (s) với O2(g)
Số khẳng định đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Dựa vào lý thuyết về năng lượng hóa học
a), c) đúng
b) sai, vì ở điều kiện chuẩn \({\Delta _f}H_{298}^o({O_2},g) = 0\)
d) sai, vì hợp chất SO 2 (g) bền hơn về mặt năng lượng so với các đơn chất S (s) và O 2 (g)
Đáp án C
Đáp án : C