Đề thi giữa kì 1 KHTN 7 Chân trời sáng tạo - Đề số 9
Câu 1: Phát biểu nào dưới đây không đúng? A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron. B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
Đề thi
I. Trắc nghiệm
Câu 1: Phát biểu nào dưới đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
C. Vỏ nguyên tử được cấu thành bởi các hạt electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Câu 2: Chọn phương án đúng. Nguyên tố hoá học là tập hợp những nguyên tử
A. có cùng số proton.
B. có cùng khối lượng nguyên tử.
C. có cùng số neutron.
D. có cùng số hạt proton, neutron và electron.
Câu 3: Nguyên tử của nguyên tố X có 2 lớp electron và có 4 electron ở lớp ngoài cùng. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kỳ 4, nhóm VI C. chu kì 4, nhóm II
B. chu kì 2, nhóm IV D. chu kì 2, nhóm II
Câu 4: Trong mật ong có nhiều fructose. Phân tử fructose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Khối lượng phân tử fructose tính theo đơn vị amu là
A. 80 amu. B. 100 amu. C. 180 amu. D. 160 amu.
Câu 5: Phát biểu nào sau đây đúng?
A. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng
B. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng
C. để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng
D. để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng
Câu 6: Phần trăm khối lượng của Cu, O trong hợp chất CuO lần lượt là
A. 20%, 80%. B. 80%, 20%. C. 30%, 70%. D. 70%, 30%.
Câu 7: Khối lượng phân tử CaCO 3 là
A. 99 amu. B. 100 amu. C. 90 amu. D. 95 amu.
Câu 8: Một chất lỏng dễ bay hơi có thành phần % khối lượng là 23,8% C, 5,9% H, 70,3% Cl. Biết phân tử khối của hợp chất là 50,5 amu. Số nguyên tử của C, H, Cl lần lượt là
A. 1, 3, 1. B. 1, 2, 1. C. 1, 1,3. D. 1, 1, 2.
Câu 9: Tổng số hạt trong hạt nhân của nguyên tử nguyên tố X là 14 hạt, trong đó số hạt không mang điện bằng số hạt mang điện. Nguyên tố X là
A. P (phosphorus). B. Ni (nitrogen). C. N (nitrogen). D. O (oxygen).
Câu 10: Công thức hóa học của hợp chất tạo bởi hai nguyên tố N và H là (biết N có hóa trị III, H có hóa trị I)
A. NH. B. NH 2 . C. NH 3 . D. N 2 H.
II. Tự luận
Câu 1: Nguyên tử của nguyên tố X có tổng số các loại hạt trong hạt nhân bằng 31. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Xác định số hiệu nguyên tử, khối lượng nguyên tử và viết kí hiệu nguyên tử của X.
Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium chloride
như sau:
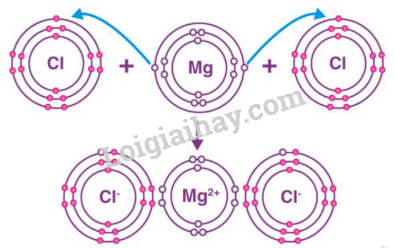
Hãy cho biết:
a. Nguyên tử Mg và nguyên tử Cl đã nhường hay nhận bao nhiêu electron.
b. Sau khi nhường (nhận) electron để hình thành liên kết ion thì lớp vỏ của nguyên tử Mg và nguyên tử Cl giống với lớp vỏ của nguyên tử khí hiếm nào?
Đáp án
Phần trắc nghiệm
|
1D |
2A |
3B |
4C |
5A |
6B |
7B |
8A |
9C |
10C |
Câu 1: Phát biểu nào dưới đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
C. Vỏ nguyên tử được cấu thành bởi các hạt electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
Phương pháp giải
Dựa vào kiến thức về nguyên tử
Lời giải chi tiết
Nguyên tử có cấu trúc rỗng
Đáp án D
Câu 2: Chọn phương án đúng. Nguyên tố hoá học là tập hợp những nguyên tử
A. có cùng số proton.
B. có cùng khối lượng nguyên tử.
C. có cùng số neutron.
D. có cùng số hạt proton, neutron và electron.
Phương pháp giải:
Các nguyên tử có cùng số proton trong hạt nhân thuộc cùng một nguyên tố hóa học.
Lời giải chi tiết:
Nguyên tố hoá học là tập hợp những nguyên tử có cùng số proton.
→ Chọn A .
Câu 3: Nguyên tử của nguyên tố X có 2 lớp electron và có 4 electron ở lớp ngoài cùng. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kỳ 4, nhóm VI C. chu kì 4, nhóm II
B. chu kì 2, nhóm IV D. chu kì 2, nhóm II
Phương pháp giải
Số lớp electron = chu kì, số electron lớp ngoài cùng = số nhóm
Lời giải chi tiết
X có 2 lớp electron => chu kì 2
X có 4 electon lớp ngoài cùng => nhóm IV
Đáp án B
Câu 4: Trong mật ong có nhiều fructose. Phân tử fructose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Khối lượng phân tử fructose tính theo đơn vị amu là
A. 80 amu. B. 100 amu. C. 180 amu. D. 160 amu.
Phương pháp giải
Dựa vào công thức của hợp chất fructose để tính khối lượng phân tử fructose
Lời giải chi tiết
Khối lượng phân tử fructose = 6.M C + 12. M H + 6. M O = 6.12 + 12.1 + 6.16 = 180 amu ( Với M: kí hiệu khối lượng nguyên tử)
Câu 5: Phát biểu nào sau đây đúng?
A. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng
B. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng
C. để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng
D. để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng
Phương pháp giải
Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhường các electron ở lớp ngoài cùng
Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhận các electron để có đủ 8 electron lớp ngoài cùng
Lời giải chi tiết
Đáp án A
Câu 6: Phần trăm khối lượng của Cu, O trong hợp chất CuO lần lượt là
A. 20%, 80%. B. 80%, 20%. C. 30%, 70%. D. 70%, 30%.
Phương pháp giải
Tính khối lượng phân tử của CuO.
Áp dụng công thức tính phần trăm khối lượng các nguyên tố trong hợp chất
Lời giải chi tiết
Khối lượng phân tử CuO = M Cu + M O = 64 + 16 = 80amu
\(\begin{array}{l}{\% _{Cu}} = \frac{{{M_{Cu}}}}{{{M_{CuO}}}}.100\% = \frac{{64}}{{80}}.100\% = 80\% \\{\% _O} = 100\% - 80\% = 20\% \end{array}\)
Đáp án B
Câu 7: Khối lượng phân tử CaCO 3 là
A. 99 amu. B. 100 amu. C. 90 amu. D. 95 amu.
Phương pháp giải
Khối lượng phân tử = tổng khối lượng các nguyên tử của nguyên tố
Lời giải chi tiết
Khối lượng phân tử CaCO 3 = khối lượng nguyên tử Ca + khối lượng nguyên tử C + 3. Khối lượng nguyên tử O = 40 + 12 + 16.3 = 100 amu
Đáp án B
Câu 8: Một chất lỏng dễ bay hơi có thành phần % khối lượng là 23,8% C, 5,9% H, 70,3% Cl. Biết phân tử khối của hợp chất là 50,5 amu. Số nguyên tử của C, H, Cl lần lượt là
A. 1, 3, 1. B. 1, 2, 1. C. 1, 1,3. D. 1, 1, 2.
Phương pháp giải
Dựa vào thành phần % khối lượng của các nguyên tố trong phân tử để xác định công thức
Lời giải chi tiết
Giả sử công thức của hợp chất: có x nguyên tử C, y nguyên tử H, z nguyên tử Cl
Công thức hóa học: C x H y Cl z
\(\begin{array}{l}\% C = \frac{{x.{M_C}}}{{{M_X}}}.100\% = 23,8\% \to x = \frac{{23,8\% .50,5}}{{12}} = 1\\\% H = \frac{{y.{M_O}}}{{{M_X}}}.100\% = 5,9\% \to y = \frac{{5,9\% .50,5}}{1} = 3\\\% Cl = \frac{{z.{M_{Cl}}}}{{{M_X}}}.100\% = 70,3\% \to z = \frac{{70,3\% .50,5}}{{35,5}} = 1\end{array}\)
Số nguyên tử của C, H, Cl lần lượt là: 1:3:1
Đáp án A
Câu 9: Tổng số hạt trong hạt nhân của nguyên tử nguyên tố X là 14 hạt, trong đó số hạt không mang điện bằng số hạt mang điện. Nguyên tố X là
A. P (phosphorus). B. Ni (nitrogen). C. N (nitrogen). D. O (oxygen).
Lời giải chi tiết
(1) P + N = 14
(2) P = N
Mà P = E nên P = E = 7, N = 7
Nguyên tố nitrogen (N)
Đáp án C
Câu 10: Công thức hóa học của hợp chất tạo bởi hai nguyên tố N và H là (biết N có hóa trị III, H có hóa trị I)
A. NH. B. NH 2 . C. NH 3 . D. N 2 H.
Phương pháp giải
Dựa vào hóa trị của nguyên tố N và H để xác định công thức hóa học
Lời giải chi tiết
Vì N có hóa trị III và H có hóa trị I => công thức hóa học của hợp chất là NH 3
II. Tự luận
Câu 1: Nguyên tử của nguyên tố X có tổng số các loại hạt trong hạt nhân bằng 31. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Xác định số hiệu nguyên tử, khối lượng nguyên tử và viết kí hiệu nguyên tử của X.
Lời giải chi tiết
Ta có: số e = số p = Z; số n = N
\(\left\{ \begin{array}{l}{\rm{Z + N = 31}}\\{\rm{ - Z\;}}\,\,{\rm{ + N = 1}}\end{array} \right. \Leftrightarrow \)\(\left\{ \begin{array}{l}{\rm{Z = 15}}\\{\rm{N = 16}}\end{array} \right.\)
Số hiệu nguyên tử = Z = 15.
Khối lượng nguyên tử: A = Z + N = 15 +16 =31
Kí hiệu nguyên tử X: \({}_{15}^{31}X\)
Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium chloride
như sau:

Hãy cho biết:
a. Nguyên tử Mg và nguyên tử Cl đã nhường hay nhận bao nhiêu electron.
b. Sau khi nhường (nhận) electron để hình thành liên kết ion thì lớp vỏ của nguyên tử Mg và nguyên tử Cl giống với lớp vỏ của nguyên tử khí hiếm nào?
Lời giải chi tiết
a) Nguyên tử Mg đã nhường 2 electron, mỗi nguyên tử Cl đã nhận 1 electron
b) Sau khi nhường 2 electron nguyên tử Mg có 8 electron lớp ngoài cùng giống với khí hiếm Ne
Sau khi nhận 1 electron nguyên tử Cl có 8 electron lớp ngoài cùng giống với khí hiếm Ar