Ethyl acetate là chất lỏng, có mùi đặc trưng, được sản xuất ở quy mô lớn làm dung môi trong công nghiệp.
(a) Viết phương trình hoá học điều chế ethyl acetate bằng cách đun nóng hỗn hợp acetic acid với ethanol, xúc tác H 2 SO 4 đặc.
(b) Sơ đồ thí nghiệm sau mô tả quá trình thực hiện phàn ứng trên. Hãy cho biết vai trò của cốc nước lạnh trong thí nghiệm. Sau khi kết thúc phản ứng, ta thêm một ít nước vào ống nghiệm, lắc nhẹ thì có hiện tượng gì xảy?

(c) Để một nhà máy sản xuất được 1000L ethyl acetate mỗi ngày thì lượng thể tích (L) ethanol và acetic acid tiêu thụ tối thiểu là bao nhiêu? Biết rằng hao hụt trong quá trình sản xuất trên là 34%. Cho khối lượng riêng (g/cm 3 ) của ethyl acetate, ethanol và acetic acid lần lượt là: 0,902; 0,79; 1,049.
(a) Phương trình hoá học:
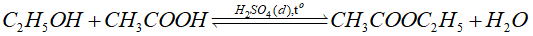
(b) Vai trò của cốc nước lạnh: ethyl acetate sinh ra dưới dạng hơi nên cần làm lạnh bằng nước đá để ngưng tụ.
Sau khi kết thúc phản ứng ta thêm một ít nước vào ống nghiệm, lắc nhẹ thì trong ống nghiệm có chất lỏng không màu, mùi đặc trưng, không tan trong nước và nổi trên mặt nước.
(c) \({n_{C{H_3}COO{C_2}{H_5}}} = \frac{{1\,000 \times {{10}^3} \times 0,902}}{{88}} = 10\,250\,(mol)\)
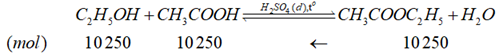
\(\begin{array}{l}{V_{C{H_3}COOH}} = \frac{{{m_{C{H_3}COOH}}}}{{{d_{C{H_3}COOH}}}} = \frac{{10\,250 \times 60}}{{1,049}} = 586\,272,64\,(c{m^3})\\{V_{{C_2}{H_5}OH}} = \frac{{{m_{{C_2}{H_5}OH}}}}{{{d_{{C_2}{H_5}OH}}}} = \frac{{10\,250 \times 46}}{{0,79}} = 596\,835,44\,(c{m^3})\end{array}\)
Theo đề, hao hụt của phản ứng là 34%, do đó hiệu suất của phản ứng là 66%.
\(\begin{array}{l}{V_{C{H_3}COOH}} = \frac{{586\,272,64 \times 100}}{{66}} = 888\,291,88\,(c{m^3}) = 888,29\,(L)\\{V_{{C_2}{H_5}OH}} = \frac{{596\,835,44 \times 100}}{{66}} = 904\,296,12\,(c{m^3}) = 904,29\,(L)\end{array}\)