Bài 2. Một số cơ chế phản ứng trong hóa học hữu cơ - Chuyên đề Hóa học 12 Chân trời sáng tạo
Hiểu rõ cơ chế phản ứng hoá học hữu cơ rất quan trọng
CH tr 10 MĐ
Hiểu rõ cơ chế phản ứng hoá học hữu cơ rất quan trọng trong việc nghiên cứu hoá học hữu cơ. Điều này dựa trên sự hiểu biết về chất phản ứng, tác nhân và điều kiện phản ứng. Làm sao để viết được cơ chế phản ứng của một số phản ứng hoá học hữu cơ phổ biến?
Phương pháp giải:
Dựa vào phần mục tiêu đầu bài.
Lời giải chi tiết:
Để viết được cơ chế phản ứng của một số phản ứng hoá học hữu cơ phổ biến cần:
- Xác định chất phản ứng và các tác nhân phản ứng.
- Nắm vững được một số cơ chế phản ứng trong hóa học hữu cơ.
- Hiểu được sự tạo thành sản phẩm và hướng của một số phản ứng.
CH tr 10 TL
Phân biệt chất phản ứng và tác nhân phản ứng.
Phương pháp giải:
Xét phản ứng hữu cơ tổng quát:
Chất phản ứng + Tác nhân phản ứng → Sản phẩm
Trong phản ứng hoá học hữu cơ, chất hữu cơ phức tạp hơn thường được gọi là chất phản ứng, chất hữu cơ đơn giản hơn hoặc chất vô cơ thường được gọi là tác nhân phản ứng.
Lời giải chi tiết:
Trong phản ứng hoá học hữu cơ, chất phức tạp hơn thường được gọi là chất phản ứng; chất hữu cơ đơn giản hơn hoặc chất vô cơ thường được gọi là tác nhân phản ứng.
CH tr 11 LT
Xác định tác nhân nucleophile hoặc electrophile trong các phản ứng sau:
\(\begin{array}{l}(1){\rm{ (C}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{C = C}}{{\rm{H}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}^{\rm{ + }}} \to {{\rm{(C}}{{\rm{H}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{{\rm{C}}^{\rm{ + }}}\\(2){\rm{ (C}}{{\rm{H}}_{\rm{3}}}{{\rm{)}}_{\rm{3}}}{{\rm{C}}^{\rm{ + }}}{\rm{ + }}{}^ - {\rm{OH}} \to {{\rm{(C}}{{\rm{H}}_{\rm{3}}}{\rm{)}}_{\rm{3}}}{\rm{C - OH}}\end{array}\)
Phương pháp giải:
Tác nhân electrophile là tác nhân có ái lực với electron, chúng thường là các tiểu phân mang điện tích dương hoặc có trung tâm mang một phần điện tích dương.
Tác nhân nucleophile là tác nhân có ái lực với hạt nhân, chúng thường là các tiểu phân mang điện tích âm hoặc có cặp electron hoá trị tự do.
Lời giải chi tiết:
- Trong phản ứng (1), \({{\rm{H}}^{\rm{ + }}}\)là tác nhân electrophile.
- Trong phản ứng (2), \({}^ - {\rm{OH}}\)là tác nhân nucleophile.
CH tr 11 TL1
Xác định các gốc tự do tạo thành trong phản ứng của methane với chlorine.
Phương pháp giải:
Tiểu phân mang electron độc thân được gọi là gốc tự do.
Lời giải chi tiết:
Các gốc tự do tạo thành trong phản ứng của methane với chlorine: \(\mathop {\rm{C}}\limits^ \bullet {{\rm{H}}_{\rm{3}}},{\rm{C}}{{\rm{l}}^ \bullet }\)
CH tr 11 TL2
Dự đoán các gốc tự do tạo thành khi cho propane tác dụng với bromine tạo thành dẫn xuất monobroma. So sánh độ bền của các gốc tự do này.
Phương pháp giải:
Dựa vào sản phẩm trong phản ứng giữa propane và bromine để dự đoán các gốc tự do tạo thành.
Độ bền của gốc tự do phụ thuộc vào bậc của nguyên tử carbon chứa electron độc thân.
Lời giải chi tiết:
- Các gốc tự do tạo thành khi cho propane tác dụng với bromine tạo thành dẫn xuất monobroma:
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}\mathop {\rm{C}}\limits^ \bullet {{\rm{H}}_{\rm{2}}};{\rm{ C}}{{\rm{H}}_3}\mathop {\rm{C}}\limits^ \bullet {\rm{HC}}{{\rm{H}}_{\rm{3}}}\).
- Gốc tự do bậc II (\({\rm{C}}{{\rm{H}}_3}\mathop {\rm{C}}\limits^ \bullet {\rm{HC}}{{\rm{H}}_{\rm{3}}}\)) bền hơn gốc tự do bậc I (\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_{\rm{2}}}\mathop {\rm{C}}\limits^ \bullet {{\rm{H}}_{\rm{2}}}\)).
CH tr 12 LT
Trình bày cơ chế phản ứng khi cho ethylene tác dụng với HBr, với H 2 O (xúc tác H + ).
Phương pháp giải:
Cơ chế phản ứng cộng electrophile (A E ) vào liên kết đôi C=C của alkene
Phản ứng cộng A E tổng quát của alkene:
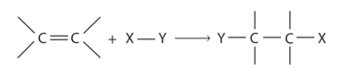
Phản ứng xảy ra qua hai giai đoạn chính:
+ Giai đoạn 1: Tác nhân electrophile phản ứng với liên kết đôi C=C tạo thành carbocation.
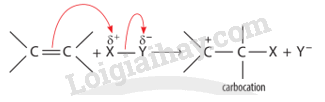
+ Giai đoạn 2: Carbocation phản ứng với anion Y" tạo thành sản phẩm.
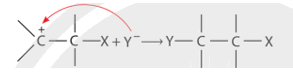
Cơ chế phản ứng của alkene với hydrogen halide HA (HCl, HBr) xảy ra như sau:
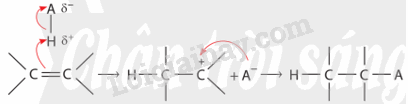
Phản ứng cộng electrophile (HCl, HBr, ...) vào alkene bất đối xứng ưu tiên xảy ra theo hướng tạo thành carbocation bền hơn (theo quy tắc Markovnikov).
Lời giải chi tiết:
- Cơ chế phản ứng khi cho ethylene tác dụng với HBr:
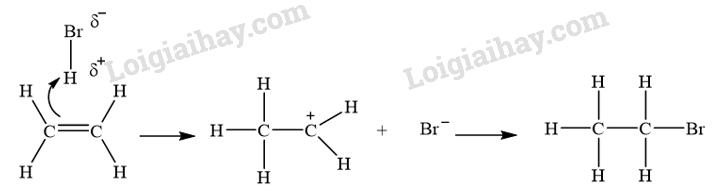
- Cơ chế phản ứng khi cho ethylene tác dụng với H 2 O (xúc tác H + ):

CH tr 12 TL2
Cho biết hướng tạo ra sản phẩm chính và hướng tạo ra sản phẩm phụ trong Ví dụ 6.
Phương pháp giải:
Độ bền tương đối của carbocation thường tăng khi bậc của nguyên tử carbon mang điện tích dương tăng.
Phản ứng cộng của alkene với X 2 (Cl 2 , Br 2 ), với HA (HCl, HBr, ...) và với H 2 O (xúc tác \({{\rm{H}}^ + }\)) xảy ra theo cơ chế cộng electrophile (A E ) qua hai giai đoạn chính và ưu tiên xảy ra theo hướng tạo carbocation bền hơn.
Lời giải chi tiết:
Phản ứng cộng HCl vào 2-methylpropene ưu tiên xảy ra theo hướng tạo carbocation bền hơn (carbocation bậc cao hơn).
Hướng (1) tạo carbocation bậc II, hướng (2) tạo carbocation bậc I. Do đó hướng (1) tạo sản phẩm chính, hướng (2) tạo sản phẩm phụ.
CH tr 13 TL
Xác định tác nhân electrophile trong phản ứng của benzene và dung dịch HNO 3 đặc và H 2 SO 4 đặc.
Phương pháp giải:
- Trong phản ứng hoá học hữu cơ, chất hữu cơ phức tạp hơn thường được gọi là chất phản ứng, chất hữu cơ đơn giản hơn hoặc chất vô cơ thường được gọi là tác nhân phản ứng.
- Tác nhân electrophile là tác nhân có ái lực với electron, chúng thường là các tiểu phân mang điện tích dương hoặc có trung tâm mang một phần điện tích dương.
Lời giải chi tiết:
Trong phản ứng của benzene và dung dịch HNO 3 đặc và H 2 SO 4 đặc, tác nhân electrophile là \({}^ + {\rm{N}}{{\rm{O}}_{\rm{2}}}\).
CH tr 13 LT
Trình bày cơ chế phản ứng khi cho benzene tác dụng với Br 2 , xúc tác FeBr 3 , tạo thành monobromobenzene. Tác nhân electrophile tạo thành từ sự kết hợp giữa Br 2 và FeBr 3 được biểu diễn như sau:
\({\rm{B}}{{\rm{r}}_2} + {\rm{FeB}}{{\rm{r}}_3} \to {\rm{B}}{{\rm{r}}^ + } + {[{\rm{FeB}}{{\rm{r}}_4}]^ - }\)
Phương pháp giải:
Các phản ứng thế nguyên tử H của vòng benzene như phản ứng halogen hoá, nitro hoá benzene xảy ra theo cơ chế thế electrophile vào nhân thơm, kí hiệu là S E Ar.
Lời giải chi tiết:
Cơ chế phản ứng khi cho benzene tác dụng với Br 2 , xúc tác FeBr 3 :
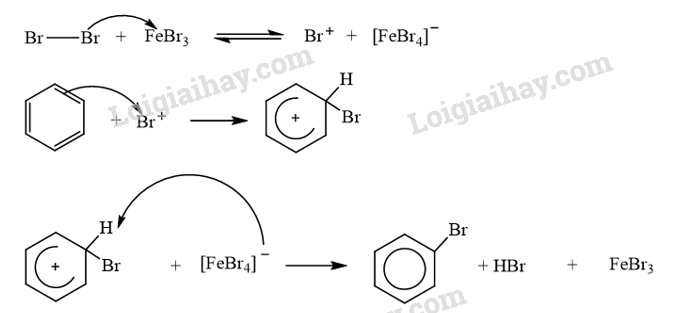
CH tr 14 TL1
Xác định tác nhân nucleophile trong phản ứng iodomethane tác dụng với dung dịch sodium hydroxide.
Phương pháp giải:
- Trong phản ứng hoá học hữu cơ, chất hữu cơ phức tạp hơn thường được gọi là chất phản ứng, chất hữu cơ đơn giản hơn hoặc chất vô cơ thường được gọi là tác nhân phản ứng.
- Tác nhân nucleophile là tác nhân có ái lực với hạt nhân, chúng thường là các tiểu phân mang điện tích âm hoặc có cặp electron hoá trị tự do.
Lời giải chi tiết:
Trong phản ứng iodomethane tác dụng với dung dịch sodium hydroxide, tác nhân nucleophile là \({\rm{H}}{{\rm{O}}^ - }\).
CH tr 14 LT
Trình bày cơ chế phản ứng thủy phân 1-bromobutane bằng dung dịch NaOH.
Phương pháp giải:
Phản ứng thủy phân dẫn xuất halogen có thể xảy ra theo cơ chế thế nucleophile S N 1 hoặc S N 2.
Lời giải chi tiết:
Phản ứng thủy phân 1-bromobutane bằng dung dịch NaOH xảy ra theo cơ chế thế nucleophile S N 2:
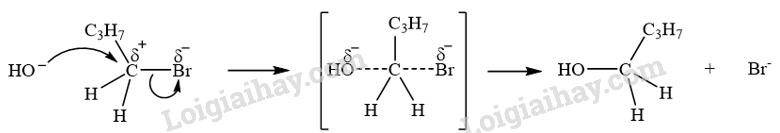
Trạng thái chuyển tiếp
CH tr 14 TL2
Xác định tác nhân nucleophile trong phản ứng khi cho acetone tác dụng với hydrogen cyanide.
Phương pháp giải:
- Trong phản ứng hoá học hữu cơ, chất hữu cơ phức tạp hơn thường được gọi là chất phản ứng, chất hữu cơ đơn giản hơn hoặc chất vô cơ thường được gọi là tác nhân phản ứng.
- Tác nhân nucleophile là tác nhân có ái lực với hạt nhân, chúng thường là các tiểu phân mang điện tích âm hoặc có cặp electron hoá trị tự do.
Lời giải chi tiết:
Tác nhân nucleophile trong phản ứng giữa acetone và hydrogen cyanide là \({}^ - {\rm{CN}}\) .
CH tr 15 BT1
Viết phương trình hoá học của phản ứng xảy ra khi cho 2-methylpropane tác dụng với bromine trong điều kiện chiếu sáng tạo thành sản phẩm 2-bromo-2-methylpropane. Giải thích bằng cơ chế phản ứng.
Phương pháp giải:
Phản ứng của alkane với Cl 2 và Br 2 theo cơ chế thế gốc S R .
Phản ứng ưu tiên theo hướng tạo thành gốc tự do bền hơn.
Lời giải chi tiết:
- Phương trình hóa học:
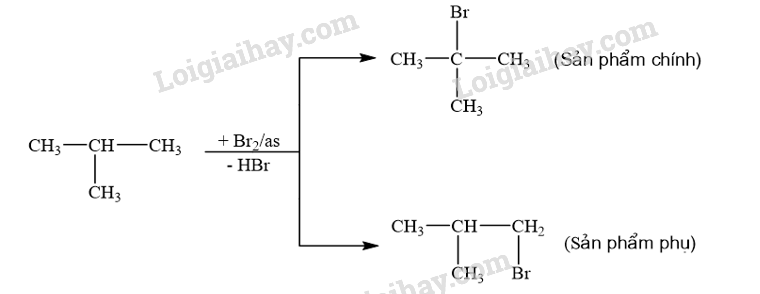
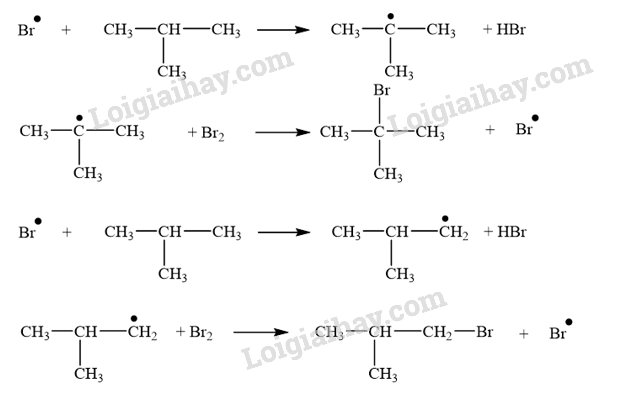
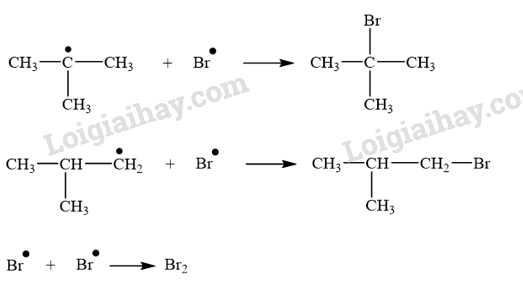
- Cơ chế phản ứng: Phản ứng ưu tiên theo hướng tạo thành gốc tự do bền hơn.
+ Giai đoạn khơi mào:
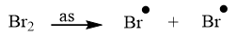
+ Giai đoạn phát triển mạch:
+ Giai đoạn tắt mạch:
CH tr 15 BT2
Trình bày cơ chế phản ứng cộng nước (xúc tác H + ) vào 2-methylpropene và xác định sản phẩm chính theo quy tắc Markovnikov.
Phương pháp giải:
Phản ứng alkene cộng nước (xúc tác H + ) xảy ra theo cơ chế cộng electrophile (A E ) qua hai giai đoạn chính và ưu tiên xảy ra theo hướng tạo carbocation bền hơn (theo quy tắc Markovnikov).
Lời giải chi tiết:
Cơ chế phản ứng cộng nước (xúc tác H + ) vào 2-methylpropene:
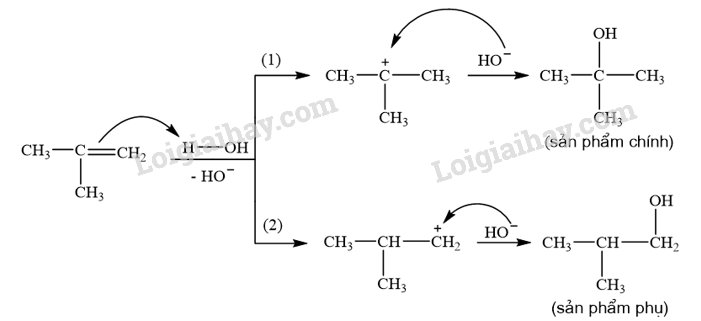
CH tr 15 BT3
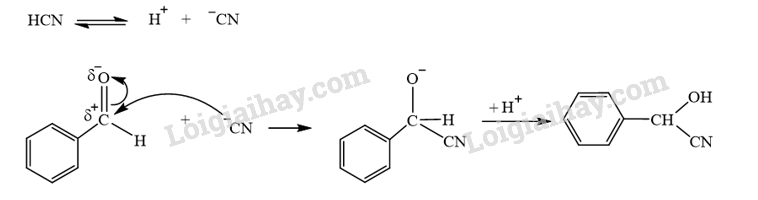
Benzaldehyde cyanohydrin có thể được tạo ra từ phản ứng hoá học giữa benzaldehyde và HCN. Viết phương trình hoá học và giải thích bằng cơ chế phản ứng.
Phương pháp giải:
Phản ứng hoá học giữa benzaldehyde và HCN xảy ra theo cơ chế cộng nucleophile (A N ).
Lời giải chi tiết:
- Phương trình hóa học:
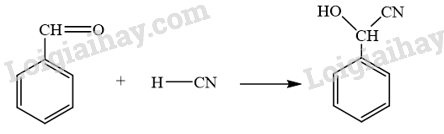
- Cơ chế phản ứng giữa benzaldehyde và HCN: