Bài 1. Khái niệm về cân bằng hóa học trang 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 Hóa học 11 Kết nối tri thức
Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
CH tr 6
|
Câu hỏi mở đầu: Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng? |
Phương pháp:
Đối với những phản ứng có sản phẩm có thể phản ứng với nhau tạo thành chất ban đầu, để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng: vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier.
Lời giải chi tiết:
Đối với những phản ứng có sản phẩm có thể phản ứng với nhau tạo thành chất ban đầu, người ta thường vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier để chuyển dịch cân bằng theo mong muốn nhằm thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng.
Theo nguyên lí Le Chatelier: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.”
=> Có thể điều chỉnh nồng độ chất tham gia hoặc sản phẩm, nhiệt độ, áp suất để phản ứng chuyển dịch theo chiều thuận, tạo ra nhiều sản phẩm hơn với hiệu suất cao hơn.
Ngoài ra, người ta còn sử dụng chất xúc tác để tăng tốc độ phản ứng.
|
Câu hỏi: Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10 L, nhiệt độ 445 o C): Thực hiện yêu cầu sau: a) Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm 1 và thí nghiệm 2. b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Giải thích. |
Phương pháp:
a) Phương trình hoá học của các phản ứng xảy ra:
- Trong thí nghiệm 1: H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g ).
- Trong thí nghiệm 2: 2HI( g ) ⇌ H 2 ( g ) + I 2 ( g ).
b) Giải thích: Phản ứng thuận nghịch.
Lời giải chi tiết:
a) Phương trình hoá học của các phản ứng xảy ra:
- Trong thí nghiệm 1: H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g ).
- Trong thí nghiệm 2: 2HI( g ) ⇌ H 2 ( g ) + I 2 ( g ).
b) Trong cả hai thí nghiệm trên, dù thời gian phản ứng kéo dài bao lâu thì các chất đầu đều còn lại sau phản ứng. Do hai phản ứng trên là phản ứng thuận nghịch, trong cùng một điều kiện, các chất phản ứng tác dụng với nhau tạo thành các chất sản phẩm (phản ứng thuận), đồng thời các chất sản phẩm lại tác dụng với nhau tạo thành các chất ban đầu (phản ứng nghịch).
Phản ứng hóa học là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành chất đầu. Đối với những phản ứng này, làm thế nào để thu được nhiều sản phẩm hơn và làm tăng hiệu suất phản ứng?
CH tr 7
|
Câu hỏi: 1. Quá trình hình thành hang động, thạch nhũ là một ví dụ điển hình về phản ứng thuận nghịch trong tự nhiên. Nước có chức CO 2 chảy qua đá vôi, bào mòn đá tạo thành Ca(HCO 3 ) 2 (phản ứng thuận) góp phần hình thành các hang động. Hợp chất Ca(HCO 3 ) 2 trong nước lại bị phân hủy tạo ra CO 2 và CaCO 3 (phản ứng nghịch), hình thành các thạch nhũ, măng đá, cột đá. Viết phương trình hóa học của các phản ứng xảy ra trong hai quá trình trên. |
Phương pháp:
Phản ứng thuận: CaCO 3 + H 2 CO 3 → Ca(HCO 3 ) 2
Trong đó: CaCO 3 là đá vôi; H 2 CO 3 là carbonic acid tự nhiên có mặt trong nước và không khí.
Phản ứng nghịch: Ca(HCO 3 ) 2 → CO 2 + H 2 O + CaCO 3
Trong đó: Ca(HCO 3 ) 2 là hợp chất có trong nước bị phân hủy, tạo ra CO 2 , H 2 O và CaCO 3 (thạch nhũ, măng đá, cột đá).
Lời giải chi tiết:
1. Phản ứng thuận: CaCO 3 + H 2 CO 3 → Ca(HCO 3 ) 2
Phản ứng nghịch: Ca(HCO 3 ) 2 → CO 2 + H 2 O + CaCO 3
CH tr 8
|
Câu hỏi: 2. Phản ứng xảy ra khi cho khí Cl 2 tác dụng với nước là một phản ứng thuận nghịch. Viết phương trình hóa học của phản ứng, xác định phản ứng thuận, phản ứng nghịch. 3. Nhận xét nào sau đây không đúng? A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu. B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau để tạo thành chất đầu. C. Phản ứng một chiều là phản ứng luôn xảy ra không hoàn toàn. D. Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện. |
Phương pháp:
2. Phản ứng xảy ra khi cho khí Cl 2 tác dụng với nước là:
Cl 2 + H 2 O ⇌ HClO + HCl
3. Đáp án C: Phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn, phụ thuộc vào điều kiện phản ứng.
Lời giải chi tiết:
2. Phương trình hoá học của phản ứng xảy ra khi cho khí Cl 2 tác dụng với nước:
Cl 2 ( aq ) + H 2 O( l ) ⇌ HCl( aq ) + HClO( aq )
Phản ứng thuận: Cl 2 + H 2 O → HCl + HClO
Phản ứng nghịch: HCl + HClO → Cl 2 + H 2 O
3. Đáp án C. vì phản ứng một chiều là phản ứng chỉ xảy ra một chiều, không có sự tạo lại chất ban đầu, nên phản ứng một chiều có thể xảy ra hoàn toàn hoặc không hoàn toàn. Ví dụ như phản ứng cháy là một phản ứng một chiều, có thể xảy ra hoàn toàn hoặc không hoàn toàn, tùy thuộc vào điều kiện phản ứng.
|
Câu hỏi: Xét phản ứng thuận nghịch: H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g ). Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong Bảng 1.1 dưới đây: a) Vẽ đồ thị biểu diễn sự thay đổi số mol các chất theo thời gian. b) Từ đồ thị, nhận xét về sự thay đổi số mol của các chất theo thời gian. c) Viết biểu thức định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó dự đoán sự thay đổi tốc độ của mỗi phản ứng theo thời gian (biết các phản ứng này đều là phản ứng đơn giản). d) Bắt đầu từ thời điểm nào thì số mol các chất trong hệ phản ứng không thay đổi nữa? |
Phương pháp:
a) Vẽ biểu đồ đường biểu diễn, trục tung là số mol, trục hoành là thời gian.
b) Nhận xét: Ban đầu chưa có sản phẩm, sau đó số mol chất tham gia giảm dần, số mol sản phẩm tăng dần cho tới khi cân bằng, số mol các chất trong hệ không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận: v thuận = k.[A] a .[B] b
- Đối với phản ứng nghịch: v nghịch = k.[C] c
Dự đoán: dựa vào biểu thức định luật tác dụng khối lượng. Tốc độ phản ứng thuận phụ thuộc vào nồng độ chất tham gia, tốc độ phản ứng nghịch phụ thuộc vào nồng độ chất sản phẩm.
d) Thời điểm phản ứng đạt trạng thái cân bằng thì số mol các chất không thay đổi nữa.
Lời giải chi tiết:
a)
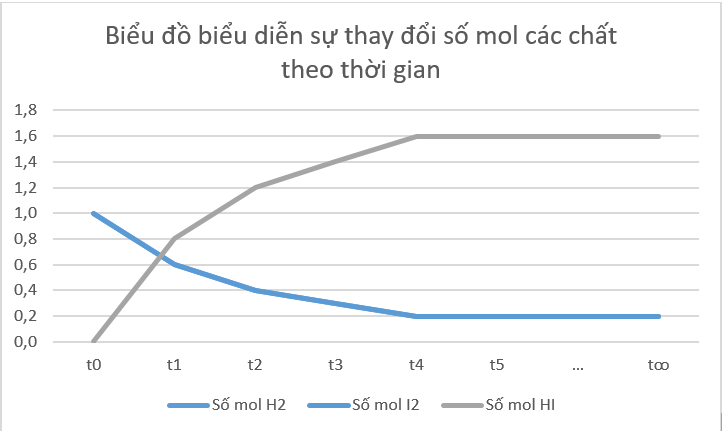
b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận:
v thuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\)
- Đối với phản ứng nghịch:
v nghịch = \({\rm{k'}}{\rm{.C}}_{{\rm{HI}}}^2\)
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa.
CH tr 9
|
Câu hỏi:
4. Cho phản ứng: 2HI (g) ⇌ H 2 (g) + l 2 (g) a) Vẽ dạng đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian. b) Xác định trên đồ thị thời điềm phản ứng trên bắt đầu đạt đến trạng thái cân bằng. 5. Cho các nhận xét sau: a) ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. b) ở trạng thái cân bằng, các chất không phản ứng với nhau. c) ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu. d) ở trạng thái cân bằng, nồng độ các chất không thay đổi. Các nhận xét đúng là: A. (a ) và (b ). B .(b ) và (c ). C . (a ) và (c). D. (a ) và (d ). |
Phương pháp giải:
4.
a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
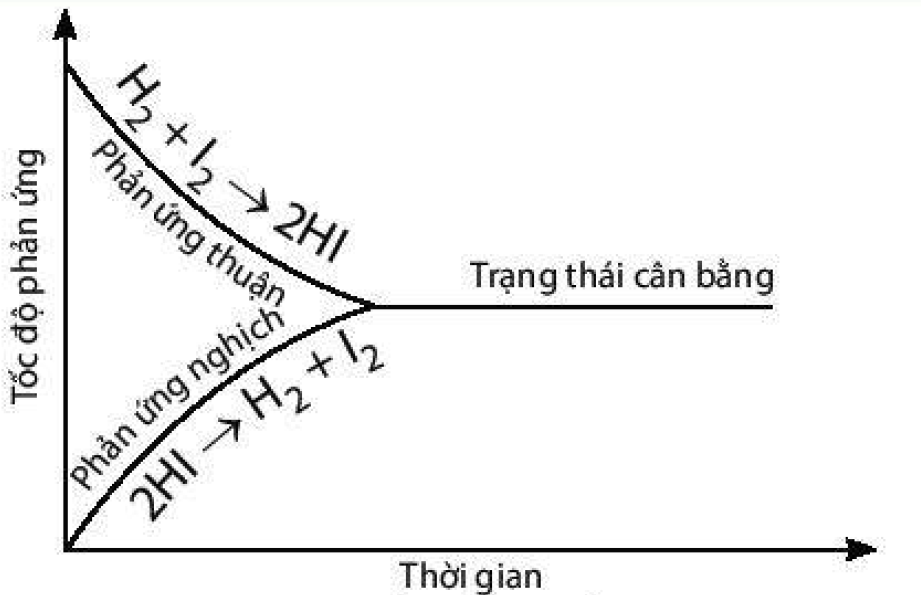
b) Thời điểm phản ứng trên bắt đầu đạt trạng thái cân bằng là thời điểm tốc độ phản ứng thuận bắt đầu bằng tốc độ phản ứng nghịch.
5. Cân bằng hoá học là một cân bằng động, các chất tham gia phản ứng liên tục phản ứng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu nhưng với tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất không thay đồi.
Lời giải chi tiết:
4.
a) Đồ thị biểu diễn tốc độ của phản ứng thuận và phản ứng nghịch theo thời gian:
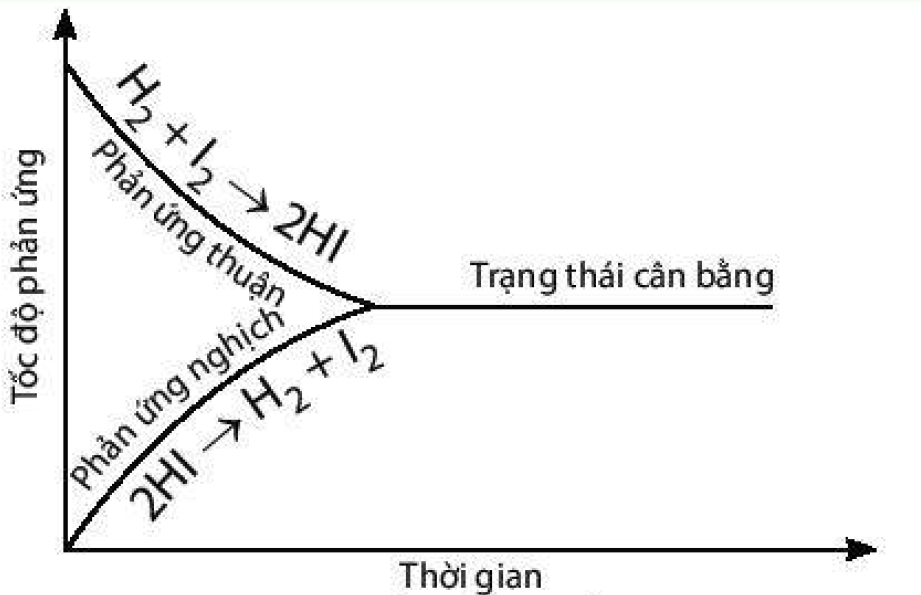
b) Điểm cân bằng của phản ứng này là điểm giao nhau giữa đường cong biểu diễn tốc độ phản ứng thuận và đường cong biểu diễn tốc độ phản ứng nghịch.
5. Các nhận xét đúng là:
a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Câu b và c sai bởi vì:
b) Ở trạng thái cân bằng, các chất không phản ứng với nhau. Là sai bởi vì các chất tham gia phản ứng liên tục phản ửng với nhau đề tạo thành sản phẩm và các chất sản phẩm cũng liên tục phản ứng với nhau đề tạo thành các chất đầu.
c) Ở trạng thái cân bằng, nồng độ các chất sản phẩm luôn lớn hơn nồng độ các chất đầu là sai bởi vì: nồng độ các chất ở trạng thái cân bằng có thể lớn hơn, bằng hoặc nhỏ hơn nồng độ các chất đầu.
|
Câu hỏi: Xét phản ứng thuận nghịch: H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g ) Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 o C với các nồng độ ban đầu khác nhau. Số liệu về nồng độ các chất ở thời điểm ban đầu và trạng thái cân bằng trong các thí nghiệm được trình bày trong Bảng 1.2. |
Phương pháp:
Áp dụng công thức \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}}\)
Lời giải chi tiết:
Giá trị hằng số cân bằng ở mỗi thí nghiệm:
- Thí nghiệm 1: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,16}^2}}}{{0,02.0,02}} = 64\)
- Thí nghiệm 2: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,18936}^2}}}{{0,00532.0,10532}} \approx 64\)
- Thí nghiệm 3: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{HI}}} \right)}^2}}}{{\left( {{{\rm{H}}_{\rm{2}}}} \right)\left( {{{\rm{I}}_{\rm{2}}}} \right)}} = \frac{{{{0,19420}^2}}}{{0,20290.0,00290}} \approx 64\)
Nhận xét: Hằng số cân bằng K C của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
CH tr 10
|
Câu hỏi: 6. Viết biểu thức hằng số cân bằng cho các phản ứng sau: a) Phản ứng tồng hợp ammonia: N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (g) b) Phản ứng nung vôi: CaCO 3 (s) ⇌ CaO(s) + CO 2 (g) 7. Ammonia (NH 3 ) được điều chế bằng phản ứng: N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (g) ở t °C, nồng độ các chất ở trạng thái cân bằng là: (N 2 ) = 0,45 M; (H 2 ) = 0,14 M; (NH 3 ) = 0,62 M. Tính hằng số cân bằng K C của phản ứng trên tại t °C. |
Phương pháp:
6. Áp dụng công thức: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {\rm{C}} \right)}^{\rm{c}}}{{\left( {\rm{D}} \right)}^{\rm{d}}}}}{{{{\left( {\rm{A}} \right)}^{\rm{a}}}{{\left( {\rm{B}} \right)}^{\rm{b}}}}}\)
7. Thay số vào công thức tìm được ở câu 6: \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}}\)
Lời giải chi tiết:
6. Biểu thức hằng số cân bằng của các phản ứng:
a) \({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}}\)
b) K C = (CO 2 )
Chú ý:
Đối với các phản ứng có chất rắn tham gia, không biểu diễn nồng độ của chất rắn trong biểu thức hằng số cân bằng.
7. Hằng số cân bằng K C của phản ứng tại t o C là:
\({{\rm{K}}_{\rm{C}}} = \frac{{{{\left( {{\rm{N}}{{\rm{H}}_3}} \right)}^2}}}{{\left( {{{\rm{N}}_{\rm{2}}}} \right){{\left( {{{\rm{H}}_{\rm{2}}}} \right)}^3}}} = \frac{{{{0,62}^2}}}{{{\rm{0}}{\rm{,45}}{\rm{.0}}{\rm{,1}}{{\rm{4}}^3}}} = 311,31\)
|
Câu hỏi thí nghiệm 1:
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng: 2NO 2 ( g ) ⇌ N 2 O 4 ( g ) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ < 0}}\) (màu nâu đỏ) (không màu) |
Phương pháp:
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ < 0}}\) nên phản ứng thuận là phản ứng tỏa nhiệt.
Lời giải chi tiết:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
|
Tăng nhiệt độ |
Màu khí trong ống nghiệm đậm dần lên |
Nghịch |
Thu nhiệt |
|
Giảm nhiệt độ |
Màu khí trong ống nghiệm nhạt dần đi |
Thuận |
Toả nhiệt |
CH tr 11
|
Câu hỏi thí nghiệm 2:
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH 3 COONa + H 2 O ⇌ CH 3 COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\) |
Phương pháp:
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\) nên phản ứng thuận là phản ứng thu nhiệt.
Lời giải chi tiết:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
|
Tăng nhiệt độ |
Màu dung dịch trong ống nghiệm đậm dần lên |
Thuận |
Thu nhiệt |
|
Giảm nhiệt độ |
Màu dung dịch trong ống nghiệm nhạt dần đi |
Nghịch |
Toả nhiệt |
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH 3 COONa + H 2 O ⇌ CH 3 COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)
CH tr 12
|
Câu hỏi thí nghiệm:
Nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng: CH 3 COOH + NaOH ⇌ CH 3 COONa + H 2 O Thí nghiệm nghiên cứu ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng trên được thực hiện như sau: |
Phương pháp:
Màu dung dịch trong ống nghiệm cho biết nồng độ sodium hydroxide tăng hay giảm, từ đó suy ra chiều chuyển dịch của cân bằng.
Lời giải chi tiết:
|
Tác động |
Hiện tượng |
Chiều chuyển dịch cân bằng (thuận/ nghịch) |
Chiều chuyển dịch cân bằng (tăng/giảm nồng độ) |
|
Tăng nồng độ CH 3 COONa |
Màu dung dịch trong ống nghiệm đậm dần lên |
Nghịch |
Giảm nồng độ CH 3 COONa |
|
Tăng nồng độ CH 3 COOH |
Màu dung dịch trong ống nghiệm nhạt dần đi |
Thuận |
Giảm nồng độ CH 3 COOH |
CH tr 13
|
Câu hỏi: 8. Cho các cân bằng sau: CaCO 3 ( s ) ⇌ CaO( s ) + CO 2 ( g ) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ}}\) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g ) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ}}\) Nếu tăng nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích. 9. Ester là hợp chất hữu cơ dễ bay hơi, một số ester được dùng làm chất tạo mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch: CH 3 COOH( l ) + C 2 H 5 OH( l ) ⇌ CH 3 COOC 2 H 5 ( l ) + H 2 O( l ) Hãy cho biết cân bằng trên chuyển dịch theo chiều nào nếu a) Tăng nồng độ của C 2 H 5 OH. b) Giảm nồng độ của CH 3 COOC 2 H 5 . |
Phương pháp giải:
8. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ tức là chiều phản ứng thu nhiệt (\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)), nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
+ Cân bằng: CaCO 3 ( s ) ⇌ CaO( s ) + CO 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ > 0}}\)⇒ Chiều thuận thu nhiệt.
+ Cân bằng: 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ < 0}}\) ⇒ Chiều thuận toả nhiệt.
9. Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
Lời giải chi tiết:
8.
+ Cân bằng: CaCO 3 ( s ) ⇌ CaO( s ) + CO 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{176 kJ > 0}}\)⇒ Chiều thuận thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều thuận , tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
+ Cân bằng: 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 198{\rm{ kJ < 0}}\) ⇒ Chiều thuận toả nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch , tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
9.
a) Tăng nồng độ của C 2 H 5 OH, cân bằng sẽ chuyển dịch theo chiều thuận , tức chiều làm giảm nồng độ của C 2 H 5 OH.
b) Giảm nồng độ của CH 3 COOC 2 H 5 , cân bằng sẽ chuyển dịch theo chiều thuận , tức chiều làm tăng nồng độ CH 3 COOC 2 H 5 .
CH tr 14
|
Câu hỏi:
10. Cho các cân bằng sau: a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g ) b) CO( g ) + H 2 O( g ) ⇌ H 2 ( g ) + CO 2 ( g ) c) PCl 5 ( g ) ⇌ Cl 2 ( g ) + PCl 3 ( g ) d) H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g ) Nếu tăng áp suất và giữ nguyên nhiệt độ, các cân bằng trên chuyển dịch theo chiều nào? Giải thích. 11. Trong công nghiệp, khí hydrogen được điều chế như sau: Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H 2 (gọi là khí than ướt): C( s ) + H 2 O( g ) ⇌ CO( g ) + H 2 Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe 2 O 3 : CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g ) a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận. b)Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Giải thích. c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích. |
Phương pháp giải:
10. Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
11.
a) Cân bằng 1: C( s ) + H 2 O( g ) ⇌ CO( g ) + H 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{130 kJ > 0}}\)⇒ Chiều thuận thu nhiệt.
Cân bằng 2: CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 42{\rm{ kJ < 0}}\)⇒ Chiều thuận toả nhiệt
b)
+ Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận ⇒ tăng hiệu suất thu khí hydrogen.
+ Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại
Lời giải chi tiết:
10. a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g )
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận , tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
b) CO( g ) + H 2 O( g ) ⇌ H 2 ( g ) + CO 2 ( g )
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
c) PCl 5 ( g ) ⇌ Cl 2 ( g ) + PCl 3 ( g )
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch , tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
d) H 2 ( g ) + I 2 ( g ) ⇌ 2HI( g )
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
11.
a)
Cân bằng 1: C( s ) + H 2 O( g ) ⇌ CO( g ) + H 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{130 kJ > 0}}\)⇒ Chiều thuận thu nhiệt.
Vậy để cân bằng (1) chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ.
Cân bằng 2: CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g )
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 42{\rm{ kJ < 0}}\)⇒ Chiều thuận toả nhiệt
Vậy để cân bằng (2) chuyển dịch theo chiều thuận cần giảm nhiệt độ của hệ.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Do:
+ Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận (tức chiều làm giảm lượng hơi nước) ⇒ tăng hiệu suất thu khí hydrogen.
+ Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại so với sử dụng lượng dư carbon monoxide.
CH tr 15
|
Câu hỏi: 12. Trong cơ thể người, hemoglobin (Hb) kết hợp với oxygen theo phản ứng thuận nghịch được biểu diễn đơn giản như sau: Hb + O 2 ⇌ HbO 2 Ở phổi, nồng độ oxygen lớn nhất nên cân bằng trên chuyển dịch sang phải, hemoglobin kết hợp với oxygen. Khi đến các mô, nồng độ oxygen thấp, cân bằng trên chuyển dịch sang trái, giải phóng oxygen. Nếu thiếu oxygen ở não, con người có thể bị đau đầu, chóng mặt. a) Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelie, em hãy đề xuất biện pháp để oxygen lên não được nhiều hơn? b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Dựa vào cân bằng trên, em hãy giải thích hiện tượng này. |
Phương pháp giải
12. a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn.
b) Do ở trên núi cao, hàm lượng oxygen loãng.
Cân bằng: Hb + O 2 ⇌ HbO 2 chuyển dịch theo chiều nghịch.
Lời giải chi tiết
12. a) Để oxygen lên não nhiều hơn thì hàm lượng oxygen hít vào phổi cũng phải nhiều hơn. Một số biện pháp đề xuất để oxygen lên não nhiều hơn:
+ Tập thể dục và hít thở đúng cách.
+ Giảm lo âu, căng thẳng và có chế độ dinh dưỡng hợp lí.
+ Không hút thuốc lá, tránh xa nơi có khói thuốc.
+ Bảo vệ môi trường không khí trong lành, tránh ô nhiễm không khí.
+ Trồng nhiều cây xanh…
b) Khi lên núi cao, một số người cũng gặp hiện tượng bị đau đầu, chóng mặt. Do ở trên núi cao, hàm lượng oxygen loãng, dẫn đến khi đến các mô cân bằng: Hb + O 2 ⇌ HbO 2 chuyển dịch theo chiều nghịch, giải phóng oxygen.