Bài 5. Một số hợp chất của nitrogen với oxygen trang 30, 31, 32, 33, 34 Hóa học 11 Chân trời sáng tạo
Nitrogen tạo những hợp chất nào với oxygen? Chúng được hình thành từ đâu và có những tính chất gì?
CH tr 30 MĐ
Nitrogen tạo những hợp chất nào với oxygen? Chúng được hình thành từ đâu và có những tính chất gì?
Phương pháp giải:
Oxide là hợp chất được tạo bởi hai nguyên tố, trong đó 1 nguyên tố là oxygen.
Trong khí quyển có chứa khí nitrogen, trong điều kiện thích hợp khí nitrogen phản ứng với oxygen tạo thành các oxide của nitrogen. Oxide của nitrogen còn có trong khí thải của động cơ.
Các oxide của nitrogen bị oxi hóa tạo acid nitric.
Lời giải chi tiết:
- Những hợp chất của nitrogen với oxygen: N 2 O, NO, NO 2 , N 2 O 5 ,…
- Nitrogen oxide được hình thành từ những hiện tượng trong tự nhiên hoặc các thiết bị hoạt động ở nhiệt độ cao.
- Tính chất: Độc, gây ảnh hưởng nghiêm trọng đến sức khoẻ con người. Khi hòa tan tỏng nước tạo thành nitric acid.
CH tr 31 CH1
Quan sát Hình 5.2, mô tả quá trình hình thành mưa acid.
Phương pháp giải:
Mưa acid là hiện tượng nước mưa có pH < 5,6.
Khi các khí sulfur dioxide, nitrogen dioxide bị oxi hóa và bị hòa tan trong nước tạo thành dung dịch acid HNO 3 và H 2 SO 4 , làm nước mưa có độ pH < 5,6, gây nên mưa acid.
Lời giải chi tiết:
Trong thành phần các chất đốt tự nhiên như than đá và dầu mỏ có chứa một lượng lớn lưu huỳnh, còn trong không khí lại chứa nhiều nitrogen. Do hoạt động của núi lửa, cháy rừng, sấm sét hoặc do con người tiêu thụ nhiều nguyên liệu tự nhiên như than đá, dầu mỏ,...tạo thành các oxide của nitrogen (NO x ) và sulfur dioxide (SO 2 ) trong khí quyển. Các khí này bị oxi hóa với xúc tác là các ion kim loại trong khói bụi,…và bị hòa tan trong nước tạo thành dung dịch acid HNO 3 và H 2 SO 4 gây ra mưa acid.
CH tr 31 CH2
Viết các phương trình hoá học của chuỗi phản ứng tạo ra nitric acid từ nitrogen trong không khí
N 2 → NO→NO 2 →HNO 3
Phương pháp giải:
Trong chuỗi phản ứng này, nguyên tố N bị oxi hóa bởi oxygen trong các điều kiện thích hợp.
Lời giải chi tiết:
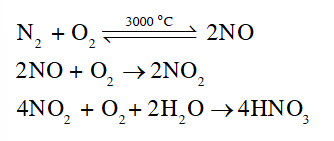
CH tr 31 CH3
Quan sát Hình 5.3, hãy nêu một số tác hại của mưa acid.
Phương pháp giải:
Mưa acid là hiện tượng nước mưa có pH < 5,6.
Tính chất hóa học của acid: phản ứng với kim loại, phản ứng với muối,…
Lời giải chi tiết:
- Mưa acid làm tăng lượng H + trong đất, khiến đất chua. Điều này làm ảnh hưởng xấu đến các loại cây trồng, sinh vật không thích nghi được với đất chua.
- Mưa acid ăn mòn các công trình làm bằng kim loại, thép, đá vôi,…
CH tr 31 CH4
Quan sát Hình 5.4a, cho biết các liên kết hoá học giữa các nguyên tử trong phân tử HNO 3 thuộc loại liên kết gì. Xác định số oxi hoá của nitrogen trong HNO 3 . Dự đoán vai trò của HNO 3 trong các phản ứng oxi hoá — khử.
Phương pháp giải:
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó cặp electron chung chỉ do một nguyên tử đóng góp.
- Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5.
- Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Lời giải chi tiết:
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO 3 là liên kết cộng hóa trị và liên kết cho nhận.
- Số oxi hóa của N trong HNO 3 là +5. Đây là số oxi hóa cao nhất của N, do đó trong các phản ứng oxi hóa – khử, HNO 3 là chất oxi hóa.
CH tr 32 CH1
Tại sao phải bảo quản nitric acid trong lọ tối màu?
Phương pháp giải:
Những hóa chất dễ bị biến đổi bởi ánh sáng được đựng trong lọ tối màu.
Lời giải chi tiết:
Dưới tác dụng của ánh sáng, nitric acid bị phân hủy tạo thành nitrogen dioxide (nhiệt độ thường)
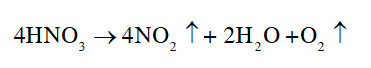
CH tr 32 CH2
Hãy tìm hiểu và cho biết HNO 3 được ứng dụng vào những lĩnh vực nào trong đời sống và sản xuất.
Tại sao phải bảo quản nitric acid trong lọ tối màu?
Phương pháp giải:
Nitric acid là một acid mạnh, tính oxi hóa mạnh. Dựa vào thành phần và tính chất hóa học, nitric acid được ứng dụng nhiều trong các lĩnh vực đời sống và sản xuất. Nitric acid là một trong ba acid chính của ngành công nghiệp hóa chất hiện đại.
Những hóa chất dễ bị biến đổi bởi ánh sáng được đựng trong lọ tối màu.
Lời giải chi tiết:
Ứng dụng của HNO 3 trong đời sống và sản xuất:
- Chế tạo thuốc nổ TNT.
- Sản xuất các loại phân bón chứa nitrogen như phân đạm một lá ammonium nitrate NH 4 NO 3 , các muối nitrate như Ca(NO 3 ) 2 , KNO 3 ,...
- Sản xuất các chất hữu cơ, sơn, bột màu, thuốc nhuộm vải.
- HNO 3 phản ứng với hầu hết với các hợp chất hữu cơ nên nó được sử dụng nhiều trong ngành luyện kim, tinh lọc và xi mạ. Khi cho nitric acid tác dụng với hydrochloric acid, ta được dung dịch cường toan có khả năng hòa tan và và bạch kim.
CH tr 32 CH3
Viết phương trình hoá học của các phản ứng khi cho dung dịch HNO 3 tác dụng với CuO, Ca(OH) 2 , CaCO 3 . Các phản ứng này có phải phản ứng oxi hoá — khử không? Giải thích.
Phương pháp giải:
Nitric acid là một acid mạnh, tính oxi hóa mạnh.
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải chi tiết:
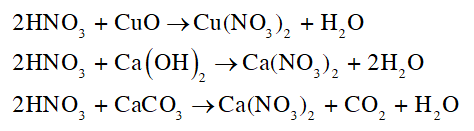
CH tr 33 CH1
Hãy cho biết dấu hiệu nhận biết hiện tượng phú dưỡng.
Phương pháp giải:
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
Có thể nhận biết hiện tượng phú dưỡng bằng cách quan sát nước ao, hồ.
Lời giải chi tiết:
Dấu hiệu: sự xuất hiện dày đặc của tảo xanh trong nước, thủy sản chết, mùi nước ao (hồ) hôi thối…
CH tr 33 CH2
Hãy nêu một số phương pháp hạn chế hiện tượng phú dưỡng.
Phương pháp giải:
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
Hạn chế hiện tượng phú dưỡng bằng cách giảm hàm lượng các nguyên tố dinh dưỡng (nitrogen, phosphorus) trong ao, hồ.
Lời giải chi tiết:
Để hạn chế nguy cơ xảy ra hiện tượng phú dưỡng trong hồ, ao:
+ Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh rạch, ao, hồ.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế sự rửa trôi ion từ nguồn phân bón dư thừa vào kênh rạch, ao, hồ.
CH tr 33 CH3
Nước thải chăn nuôi là một trong những yếu tố gây nên hiện tượng phú dưỡng cho ao, hồ. Hãy giải thích điều này.
Phương pháp giải:
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
Lời giải chi tiết:
Nước thải chăn nuôi chứa lượng lớn nitrogen và phosphorus. Nước thải chăn nuôi chưa qua xử lí, xả vào các ao, hồ, làm tăng hàm lượng nguyên tố dinh dưỡng (nitrogen, phosphorus) trong ao, hồ gây nên hiện tượng phú dưỡng.
CH tr 34 BT1
Trong công nghiệp, người ta sản xuất nitric acid (HNO 3 ) từ ammonia theo sơ đồ chuyển hoá sau:

a) Viết các phương trình hoá học xảy ra.
b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia? Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Phương pháp giải:
Bảo toàn nguyên tố N để tính số mol của ammonia từ nitric acid.
Lời giải chi tiết:

CH tr 34 BT2
Trong thực tế, ở nhiều nơi, nước thải, phân bón hoá học, thuốc trừ sâu chưa qua xử lí được thải trực tiếp vào ao, hồ. Trường hợp nào có thể gây ra hiện tượng phú dưỡng? Giải thích.
Phương pháp giải:
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
Trong nước thải, phân bón hóa học chứa nhiều nguyên tố nitrogen và phosphorus.
Lời giải chi tiết:
Nước thải, phân bón hoá học chứa nhiều các nguyên tố dinh dưỡng như nitrogen, phosphorus … Khi xả nước thải, phân bón hóa học chưa qua xử lí xuống ao, hồ, hàm lượng nguyên tố dinh dưỡng (nitrogen, phosphorus) trong ao, hồ tăng; nếu không tiêu thụ hết các nguyên tố dinh dưỡng này sẽ gây ra tình trạng dư, thừa, dẫn đến hiện tượng phú dưỡng.
CH tr 34 BT3
Khí thải có chứa NO 2 góp phần gây ra mưa acid và hiện tượng phú dưỡng. Giải thích.
Phương pháp giải:
Phú dưỡng là hiện tượng ao, hồ dư quá nhiều các nguyên tố dinh dưỡng (nitrogen, phosphorus).
Trong khí thải NO 2 chứa nguyên tố N. NO 2 là oxide acid, khi tan trong nước và khí oxygen tạo nitric acid.
Lời giải chi tiết:
- Khí thải chứa NO 2 tan trong nước và khí oxygen tạo nitric acid theo phương trình hóa học:
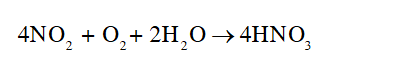
Acid làm tăng nồng độ H + trong nước mưa, độ pH trong nước mưa giảm gây ra mưa acid.
- Khi mưa acid chứa HNO 3 rớt xuống ao, hồ, làm tăng hàm lượng nguyên tố N; nếu không tiêu thụ hết các nguyên tố dinh dưỡng như N trong ao, hồ sẽ gây ra tình trạng dư, thừa, dẫn đến hiện tượng phú dưỡng.