Bài 13. Phản ứng oxi hóa – khử trang 37, 38, 39 SBT Hóa 10 Cánh diều
Số oxi hoá của chromium (Cr) trong Na2CrO4 là? Số oxi hoá của Cl trong các chất NaOCl, NaClO2, NaClO3, NaClO4 lần lượt là?Tìm hiểu và xác định số oxi hóa của từng nguyên tử Fe trong magnetite.
CH tr 37 13.1
Phát biểu nào sau đây là đúng?
A. Số oxi hoá của nguyên tử trong bất kì một đơn chất hoá học nào đều bằng 0.
B. Tổng số oxi hoá của tất cả các nguyên tử trong một phân tử và trong một ion đa nguyên tử bằng 0.
C. Trong tất cả các hợp chất, hydrogen luôn có số oxi hoá là +1.
D. Trong tất cả các hợp chất, oxygen luôn có số oxi hoá là -2.
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
- Đáp án: A
CH tr 37 13.2
Phát biểu nào sau đây không đúng ?
A. Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử đó với giả thiết đó là hợp chất ion.
B. Trong hợp chất, oxygen có số oxi hoá bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hoá của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hoá thay đổi tuỳ thuộc vào hợp chất chứa chúng.
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
- Đáp án: C
- Giải thích: trong các hydride kim loại, hydrogen có số oxi hóa là -1
CH tr 37 13.3
Số oxi hoá của chromium (Cr) trong Na 2 CrO 4 là
A. -2. B. +2. C. +6. D. -6.
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
- Đặt x là số oxi hóa của Cr
- Trong Na 2 CrO 4 , ta có: 1.2 + x.1 + (-2).4 = 0 → x = +6
→ Đáp án: C
CH tr 37 13.4
Số oxi hoá của carbon và oxygen trong C 2 O 4 2- lần lượt là:
A. +3, -2. B. +4, -2. C. +1, -3. D. +3, -6.
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
- Đặt x là số oxi hóa của C
- Trong C 2 O 4 2- , ta có: x.2 + (-2).4 = -2 → x = +3
→ Đáp án: A
CH tr 37 13.5
Số oxi hoá của Cl trong các chất NaOCl, NaClO 2 , NaClO 3 , NaClO 4 lần lượt là:
A. -1, +3, +5, +7. B. +1, -3, +5, -2.
C. +1, +3, +5, +7. D. +1, +3, -5, +7.
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
NaOCl, NaClO 2 , NaClO 3 , NaClO 4
Đặt x là số oxi hóa của Cl
- Trong NaOCl: 1.1 + x.1 + (-2).1 = 0 → x = +1
- Trong NaClO 2 : 1.1 + x.1 + (-2).2 = 0 → x = +3
- Trong NaClO 3 : 1.1 + x.1 + (-2).3 = 0 → x = +5
- Trong NaClO 4 : 1.
CH tr 37 13.6
: a) Xác định số oxi hoá của mỗi nguyên tử trong các chất hoá học hoặc các ion sau: NO 3 - ; H 2 PO 4 - ; CaHAsO 4 ; Mg 2 TiO 4 .
b) Ghép phân tử/ ion ở cột A với nhóm số oxi hoá của các nguyên tử trong phân tử/ ion ở cột B cho phù hợp.
|
Cột A Phân tử/ion |
Cột B Số oxi hoá của các nguyên tử trong phân tử/ion (lần lượt theo thự tự như trong phân tử/ion |
|
a) SbCl 5 |
1. (-3; +1) |
|
b) BrO 3 - |
2. (+5; -1) |
|
c) Na 2 O 2 |
3. (+1; -2) |
|
d) Na 2 S |
4. (+1; -1) |
|
e) NH 4 + |
5. (+5; -2) |
|
6. (-1; +2) |
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
a) \(\mathop N\limits^{ + 5} \mathop {{O_3}^ - }\limits^{ - 2} ;{\rm{ }}\mathop {{H_2}}\limits^{ + 1} \mathop P\limits^{ + 5} \mathop {{O_4}^ - }\limits^{ - 2} ;{\rm{ }}\mathop {Ca}\limits^{ + 2} \mathop H\limits^{ + 1} \mathop {As}\limits^{ + 5} \mathop {{O_4}}\limits^{ - 2} ;{\rm{ }}\mathop {M{g_2}}\limits^{ + 2} \mathop {Ti}\limits^{ + 4} \mathop {{O_4}}\limits^{ - 2} \)
b) a - 2; b - 5; c - 4; d - 3; e - 1
CH tr 38 13.7
Dựa vào công thức cấu tạo, hãy xác định số oxi hóa của mỗi nguyên tố trong các hợp chất sau:
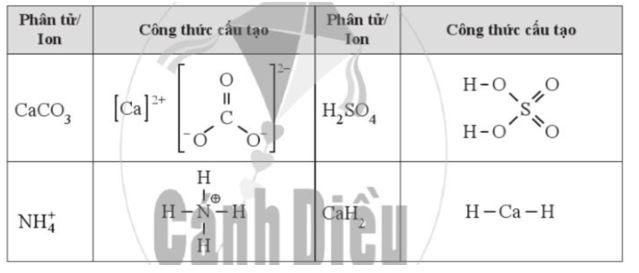
Phương pháp giải:
Dựa vào các quy tắc xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH 2 ,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF 2 và các peroxide, superoxide như (H 2 O 2 , Na 2 O 2 , KO 2 ,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1
Lời giải chi tiết:
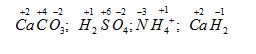
CH tr 38 13.8
Magnetite là một loại sắt oxide có công thức Fe 3 O 4 (còn gọi là oxide sắt từ). Chất này được coi là hỗn hợp của hai oxide. Tìm hiểu và xác định số oxi hóa của từng nguyên tử Fe trong magnetite.
Lời giải chi tiết:
- Fe 3 O 4 được coi là hỗn hợp của hai oxide là FeO và Fe 2 O 3 với số oxi hóa của nguyên tử Fe tương ứng là +2 và +3
CH tr 38 13.9
Những phát biểu nào sau đây đúng?
A. Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
B. Trong quá trình oxi hoá, chất khử nhận electron.
C. Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá.
D. Trong quá trình khử, chất oxi hoá nhường electron.
E. Trong quá trình khử, chất oxi hoá nhận electron và bị khử xuống số oxi hoá thấp hơn.
G. Trong quá trình oxi hoá, chất khử nhường electron và bị oxi hoá lên số oxi hoá cao hơn.
Phương pháp giải:
Dựa vào đặc điểm của các quá trình nhường và nhận electron
- Quá trình nhường electron: làm tăng số oxi hóa của nguyên tử
- Quá trình nhận electron: làm giảm số oxi hóa của nguyên tử
Lời giải chi tiết:
- Đáp án: A, C, E và G
CH tr 39 13.10
Những phát biểu nào sau đây không đúng ?
A. Chất khử (chất bị oxi hoá) là chất nhường electron và chất oxi hoá (chất bị khử) là chất nhận electron.
B. Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hoá.
C. Trong quá trình oxi hoá, chất oxi hoá bị oxi hoá lên số oxi hoá cao hơn.
D. Trong quá trình khử, chất khử bị khử xuống số oxi hoá thấp hơn.
E. Phản ứng trong đó có sự trao đổi electron là phản ứng oxi hoá - khử.
G. Trong phản ứng oxi hoá - khử, sự oxi hoá và sự khử luôn xảy ra đồng thời.
Phương pháp giải:
Dựa vào đặc điểm của các quá trình nhường và nhận electron
- Quá trình nhường electron: làm tăng số oxi hóa của nguyên tử
- Quá trình nhận electron: làm giảm số oxi hóa của nguyên tử
- Định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
Lời giải chi tiết:
- Đáp án: B, C, D
CH tr 39 13.11
Điền vào chỗ trống trong đoạn thông tin sau:
Phản ứng Fe 2 O 3 + CO → Fe + CO 2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó C + 2 … (4) … electron và Fe 2 O 3 là … (5)…, trong đó mỗi Fe + 3 … (6)… electron.
Lời giải chi tiết:
(1) oxi hóa - khử (2) số oxi hóa (3) chất khử
(4) nhường 2 (5) chất oxi hóa (6) nhận 3
Ch tr 39 13.12
Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS 2 , theo sơ đồ sau: FeS 2 → SO 2 → SO 3 → H 2 SO 4
a) Hoàn thành sơ đồ trên bằng các phương trình hoá học, cân bằng các phương trình hoá học đó. Trong sơ đồ trên, những phản ứng nào là phản ứng oxi hoá - khử? Chỉ rõ chất khử và chất oxi hoá của mỗi phản ứng đó.
b) Tính khối lượng H 2 SO 4 98% điều chế được từ 1 tấn quặng chứa 60% FeS 2 . Biết hiệu suất cả quá trình là 80%.
c) Đề xuất một công thức cấu tạo phù hợp cho FeS 2 , biết S có số oxi hoá -1 trong chất này.
Phương pháp giải:
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
→ Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải chi tiết:
a) *Phương trình FeS 2 + O 2 \(\xrightarrow{{{t}^{o}}}\) Fe 2 O 3 + SO 2
- Bước 1: \(\overset{+2}{\mathop{Fe}}\,\overset{-1}{\mathop{{{S}_{2}}}}\,+\text{ }\overset{0}{\mathop{{{O}_{2}}}}\,\xrightarrow{{{t}^{o}}}~\overset{+3}{\mathop{F{{e}_{2}}}}\,\overset{-2}{\mathop{{{O}_{3}}}}\,+\text{ }\overset{+4}{\mathop{S}}\,{{O}_{2}}\)
" FeS 2 là chất khử, O 2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(2{{(\overset{{}}{\mathop{Fe}}\,{{S}_{2}})}^{0}}\to \overset{+3}{\mathop{2Fe}}\,+4\overset{+4}{\mathop{S}}\,+22e\)
+ Quá trình khử: \(\overset{0}{\mathop{{{O}_{2}}}}\,+4e\to 2\overset{-2}{\mathop{{{O}_{2}}}}\,\)
- Bước 3:
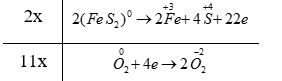
- Bước 4: 4FeS 2 + 11O 2 \(\xrightarrow{{{t}^{o}}}\) 2Fe 2 O 3 + 8SO 2

- Bước 3:
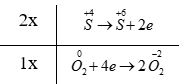
- Bước 4:
![]()
*Phương trình SO 3 + H 2 O → H 2 SO 4 (3)
- Có \({n_{Fe{S_2}}} = \frac{{1000000.60\% }}{{120}} = 5000\) mol
- Áp dụng bảo toàn nguyên tố S ta có: \({n_{{H_2}S{O_4}}} = 2{n_{Fe{S_2}}}.80\% = 2.5000.80\% = 8000\)mol
→ \({m_{{H_2}S{O_4}}} = \frac{{8000.98}}{{98\% }} = 800000\) gam = 0,8 tấn
c) Công thức cấu tạo phù hợp cho FeS 2 :

CH tr 39 13.13
Trong những phản ứng hoá học xảy ra theo các phương trình dưới đây, những phản ứng nào là phản ứng oxi hoá - khử?
(1) PCl 3 + Cl 2 → PCl 5
(2) Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag
(3) CO 2 + 2LiOH → Li 2 CO 3 + H 2 O
(4) FeCl 2 + 2NaOH → Fe(OH) 2 + 2NaCl
Chọn phương án đúng.
A. (3). B. (4).
C. (1) và (2). D. (1), (2) và (3).
Với phương án đã chọn, chỉ ra chất khử, chất oxi hóa và viết các quá trình oxi hóa và quá trình khử tương ứng.
Phương pháp giải:
Dựa vào định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
→ Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
Lời giải chi tiết:
Đáp án: C
(1) - Bước 1: \(\mathop P\limits^{ + 3} C{l_3}\; + \mathop {C{l_2}}\limits^0 \; \to \mathop P\limits^{ + 5} \mathop {C{l_5}}\limits^{ - 1} \)
→ PCl 3 là chất khử, Cl 2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop P\limits^{ + 3} \to \mathop P\limits^{ + 5} + 2e\)
+ Quá trình khử: \(\mathop {C{l_2}}\limits^0 + 2e \to 2\mathop {Cl}\limits^{ - 1} \)
(2) - Bước 1: \(\mathop {Cu}\limits^0 + 2\mathop {Ag}\limits^{ + 1} N{O_3}\; \to \mathop {Cu}\limits^{ + 2} {\left( {N{O_3}} \right)_2}\; + 2\mathop {Ag}\limits^0 \)
→ Cu là chất khử, AgNO 3 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop {Ag}\limits^{ + 1} + 1e \to \mathop {Ag}\limits^0 \)
CH tr 40 13.14
Hãy xác định chất bị khử, chất bị oxi hóa trong các phản ứng hóa học dưới đây.
a) 2HNO 3 + 3H 3 AsO 3 → 2NO + 3H 3 AsO 4 + H 2 O
b) NaI + 3HOCl → NaIO 3 + 3HCl
c) 2KMnO 4 + 5H 2 C 2 O 4 + 3H 2 SO 4 → 10CO 2 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
d) 6H 2 SO 4 + 2Al → Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Phương pháp giải:
Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
→ Xác định chất oxi hóa, chất khử
Lời giải chi tiết:
a) \(2H\mathop N\limits^{ + 5} {O_3}\; + 3{H_3}\mathop {As}\limits^{ + 3} {O_3}\; \to 2\mathop N\limits^{ + 2} O + 3{H_3}\mathop {As}\limits^{ + 5} {O_4}\; + {H_2}O\)
→ H 3 AsO 3 là chất khử, HNO 3 là chất oxi hóa
b) \(Na\mathop I\limits^{ - 1} + 3HO\mathop {Cl}\limits^{ + 1} \to Na\mathop I\limits^{ + 5} {O_3}\; + 3H\mathop {Cl}\limits^{ - 1} \)
→ NaI là chất khử, HClO là chất oxi hóa
c) \(2K\mathop {Mn}\limits^{ + 7} {O_4} + 5{H_2}\mathop {{C_2}}\limits^{ + 3} {O_4} + 3{H_2}S{O_4} \to 10\mathop C\limits^{ + 4} {O_2} + {K_2}S{O_4} + 2\mathop {Mn}\limits^{ + 2} S{O_4} + 8{H_2}O\)
→ H 2 C 2 O 4 là chất khử, KMnO 4 là chất oxi hóa
d) \(6{H_2}\mathop S\limits^{ + 6} {O_4} + 2\mathop {Al}\limits^0 \to \mathop {A{l_2}}\limits^{ + 3} {\left( {S{O_4}} \right)_3} + 3\mathop S\limits^{ + 4} {O_2} + 6{H_2}O\)
→ Al là chất khử, H 2 SO 4 là chất oxi hóa
CH tr 40 13.15
Viết các phản ứng cho quá trình oxi hóa, quá trình khử và cân bằng các phản ứng sau:
a) Ag + + Fe 2+ → Ag + Fe 3+ b) Cr 3+ + Zn → Cr + Zn 2+
c) CH 4 + O 2 → CO 2 + H 2 O d) MnO 2 + Al → Mn + Al 2 O 3
Lời giải chi tiết:
a) - Bước 2:
+ Quá trình oxi hóa: \(\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e\)
+ Quá trình khử: \(\mathop {Ag}\limits^{ + 1} + 1e \to \mathop {Ag}\limits^0 \)
- Bước 3:
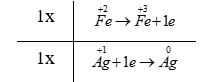
b) - Bước 2:
+ Quá trình oxi hóa: \(\mathop {Zn}\limits^0 \to \mathop {Zn}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop {Cr}\limits^{ + 3} + 3e \to \mathop {Cr}\limits^0 \)
- Bước 3:
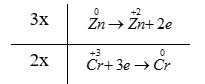
- Bước 4: 2Cr 3+ + 3Zn → 2Cr + 3Zn 2+
c) - Bước 2:
+ Quá trình oxi hóa: \(\mathop C\limits^{ - 4} \to \mathop C\limits^{ + 4} + 8e\)
+ Quá trình khử: \)\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \)
- Bước 3:
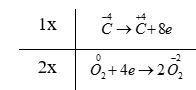
- Bước 4: CH 4 + 2O 2 → CO 2 + 2H 2 O
d) - Bước 2:
+ Quá trình oxi hóa: \(2.\mathop {Al}\limits^0 \to 2.\mathop {Al}\limits^{ + 3} + 2.3e\)
+ Quá trình khử: \(\mathop {Mn}\limits^{ + 4} + 4e \to \mathop {Mn}\limits^0 \)
- Bước 3
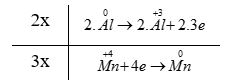
- Bước 4: 3MnO 2 + 4Al → 3Mn + 2Al 2 O 3
CH tr 40 13.16
Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN 3 ), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N 2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Viết phương trình hoá học của phản ứng xảy ra và xác định đây có phải là phản ứng oxi hoá - khử không. Vì sao? Xác định số oxi hoá của mỗi nguyên tử trong NaN 3 .
Phương pháp giải:
Dựa vào định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
Lời giải chi tiết:
- Phản ứng: \(2\mathop {Na}\limits^{ + 1} \mathop {{N_3}}\limits^{ - \frac{1}{3}} \to 2\mathop {Na}\limits^0 + 3\mathop {{N_2}}\limits^0 \)
→ Đây là phản ứng oxi hóa khử vì số oxi hóa của nguyên tử Na và N đã thay đổi sau phản ứng
CH tr 40 16.17*
Sự cháy của hydrocarbon trong oxygen:
Quá trình đốt cháy nhiên liệu (khí đốt, xăng, dầu hoặc khí hoá lỏng) là một ví dụ về sự cháy của hydrocarbon trong oxygen và cung cấp cho chúng ta năng lượng. Nếu oxygen dư thì sự cháy xảy ra hoàn toàn và cho sản phẩm là CO 2 và nước. Nếu thiếu oxygen, sự cháy xảy ra không hoàn toàn và một phần carbon chuyển thành CO là một khí độc, gây ô nhiễm môi trường. Còn khi rất thiếu oxygen thì chỉ tạo ra nước và để lại muội là carbon. Hãy viết các phương trình hoá học cho phản ứng cháy của xăng (octane – C 8 H 18 ) trong ba điều kiện: dư oxygen, không dư oxygen và rất thiếu oxygen. Theo em, điều kiện nào sẽ tiết kiệm năng lượng nhất? Vì sao? Trong điều kiện đó, một phân tử C 8 H 18 sẽ nhường bao nhiêu electron?
Lời giải chi tiết:
- Dư oxygen: 2C 8 H 18 + 25O 2 \(\xrightarrow{{{t}^{o}}}\) 16CO 2 + 18H 2 O
- Không dư oxygen: 2C 8 H 18 + 17O 2 \(\xrightarrow{{{t}^{o}}}\) 16CO + 18H 2 O
- Thiếu oxygen: 2C 8 H 18 + 9O 2 \(\xrightarrow{{{t}^{o}}}\) 16C + 18H 2 O
- Điều kiện dư oxygen sẽ tiết kiệm năng lượng nhất vì khi đó C 8 H 18 phản ứng hoàn toàn và không gây ô nhiễm môi trường. Trong điều kiện đó, mỗi phân tử C 8 H 18 nhường 50 electron
\(8.\mathop C\limits^{ - \frac{9}{4}} \to 8.\mathop C\limits^{ + 4} + 8.\frac{{25}}{4}e\)