Bài 2. Thành phần của nguyên tử trang 4, 5, 6 SBT Hóa 10 Cánh diều
Phát biểu nào sau đây là không đúng? A. Tất cả các nguyên tử đều có proton, neutron và electron. B. Proton và electron là các hạt mang điện, neutron là hạt không mang điện. Nguyên tử được tạo nên từ ba loại hạt cơ bản. Hãy hoàn thành bảng mô tả về mỗi loại hạt sau:
CH tr 4 2.1
Phát biểu nào sau đây là không đúng ?
A. Tất cả các nguyên tử đều có proton, neutron và electron.
B. Proton và electron là các hạt mang điện, neutron là hạt không mang điện.
C. Electron tạo nên lớp vỏ nguyên tử.
D. Số lượng proton và electron trong nguyên tử là bằng nhau.
Lời giải chi tiết:
- Đáp án: A
- Giải thích: Nguyên tử hydrogen chỉ gồm proton và electron, không có neutron.
CH tr 4 2.2
Chọn từ thích hợp điền vào chỗ trống trong mỗi phát biểu sau:
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở ……
b) Kích thước hạt nhân rất …… so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian …… chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là ……
Lời giải chi tiết:
a) Trong nguyên tử, khối lượng tập trung chủ yếu ở hạt nhân.
b) Kích thước hạt nhân rất nhỏ so với kích thước nguyên tử.
c) Trong nguyên tử, phần không gian rỗng chiếm chủ yếu.
d) Trong thí nghiệm của Thomson, hạt tạo nên tia âm cực là electron.
CH tr 4 2.3
Những phát biểu nào sau đây là đúng?
A. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 proton.
B. Nếu một nguyên tử có 17 electron thì nguyên tử đó cũng có 17 neutron.
C. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 proton.
D. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 neutron.
E. Nếu một nguyên tử có 17 electron thì ion tạo ra từ nguyên tử đó có 17 electron.
Phương pháp giải:
: Dựa vào c
- Các nguyên tử trung hòa về điện thì số proton = số electron
- Ion của một nguyên tử sẽ giữ nguyên số proton như nguyên tử ban đầu nhưng khác số electron
Lời giải chi tiết:
- Đáp án: A và C
- Giải thích:
+ B sai vì số neutron trong nguyên tử có thể bằng hoặc khác số electron, không thể xác định số neutron của nguyên tử bằng cách dựa vào số electron.
+ D sai vì không thể xác định số neutron của ion bằng việc dựa vào số electron.
+ E sai vì số electron của ion khác số electron của nguyên tử. Nếu nguyên tử mất electron thì tạo ion dương; nếu nguyên tử nhận electron thì tạo ion âm.
CH tr 4 2.4
Nguyên tử được tạo nên từ ba loại hạt cơ bản. Hãy hoàn thành bảng mô tả về mỗi loại hạt sau:
|
Loại hạt |
Khối lượng (amu) |
Điện tích (e 0 ) |
|
(1) |
(2) |
0 |
|
(3) |
0,00055 |
(4) |
|
(5) |
(6) |
(7) |
Phương pháp giải:
Dựa vào thông tin về khối lượng amu và điện tích e 0 của ba loại hạt cơ bản trong nguyên tử (electron, proton và neutron)
Lời giải chi tiết:
|
Loại hạt |
Khối lượng (amu) |
Điện tích (e 0 ) |
|
neutron |
1 |
0 |
|
electron |
0,00055 |
-1 |
|
proton |
1 |
+1 |
CH tr 4 2.5
Những phát biểu nào dưới đây không đúng ?
A. Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu.
B. Có những nguyên tử không chứa neutron nào.
C. Một số nguyên tử không có bất kì proton nào.
D. Điện tích của proton và neutron có cùng độ lớn nhưng ngược dấu.
E. Trong nguyên tử, số hạt proton luôn bằng số hạt electron.
G. Khối lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng của electron.
Lời giải chi tiết:
- Đáp án: C và D.
- Giải thích:
+ C sai vì nguyên tử có thể không có neutron nhưng bắt buộc phải có proton.
+ D sai vì neutron không mang điện.
CH tr 5 2.6
Biết rằng một loại nguyên tử đồng (Cu) có 29 proton và 34 neutron. Những phát biểu nào sau đây là đúng?
A. Nguyên tử đồng có 29 electron.
B. Hạt nhân nguyên tử đồng trên có tổng số hạt là 63.
C. Ion Cu + có 28 electron.
D. Ion Cu + có 30 electron.
E. Ion Cu + có 28 proton.
Lời giải chi tiết:
- Đáp án: A, B, C
- Giải thích:
+ A đúng vì trong nguyên tử số proton = số electron
+ B đúng vì hạt nhân nguyên tử đồng có 29 proton + 34 neutron = 63 hạt
+ C đúng và D sai vì Cu nhường 1 electron tạo ion Cu + .
Số electron của Cu + = 29 - 1 = 28
+ E sai vì ion Cu+ có số proton bằng số proton của nguyên tử Cu là 29
CH tr 5 2.7
Một trong số những phản ứng phổ biến nhất giữa ion và các phân tử ở các đám khí trong vũ trụ là:
H 2 + H 2 + → H + H 3 +
Biết nguyên tử H có 1 proton và 1 electron. Số proton, neutron và electron của ion H 3 + lần lượt là
A. 2 p; 1 n và 1 e. B. 2 p; 1 n và 2 e.
C. 3 p; 0 n và 1 e. D. 3 p; 0 n và 2 e.
Phương pháp giải:
Dựa vào:
- Số neutron và proton trong nguyên tử và ion của nguyên tử đó không thay đổi
- Số electron trong nguyên tử và ion có sự thay đổi
+ Ion dương bao nhiêu thì số electron trong ion giảm đi bấy nhiêu so với số electron trong nguyên tử
+ Ion âm bao nhiêu thì số electron trong ion tăng lên bấy nhiêu so với số electron trong nguyên tử
Lời giải chi tiết:
- Đáp án: D
- Giải thích:
+ Số proton của ion H 3 + bằng tổng số proton của 3 nguyên tử H là 3.
+ Nguyên tử H không có neutron → ion H 3 + không có neutron.
+ Vì ion H 3 + mang điện tích 1+ → số proton nhiều hơn số electron là 1
→ ion H 3 + có 2 electron.
CH tr 5 2.8
Một nguyên tử C có 6 proton và 6 neutron. Một nguyên tử O có 8 proton và 8 neutron. Xét các phân tử CO và CO 2 tạo nên từ các nguyên tử O và C ở trên. Hãy nối mỗi vế ở cột A tương ứng với 1 hoặc nhiều vế ở cột B
|
Cột A a) Phân tử CO b) Phân tử CO 2 |
Cột B 1. có số proton và số neutron bằng nhau 2. có khối lượng xấp xỉ 28 amu 3. có khối lượng xấp xỉ 44 amu 4. có 22 electron 5. có số hạt mang điện nhiều gấp hai lần số hạt không mang điện |
Lời giải chi tiết:
- Đáp án: a - 1, 2, 5 và b - 1, 3, 4, 5.
- Giải thích:
+ Phân tử CO:
- · Số proton = số neutron = số electron = 6 + 8 = 14
· M = (6 .1 + 6 .1) + (8 .1 + 8 .1) = 28 amu
· Số hạt mang điện = 2.(6 + 8) = 28 = 14.2 -> số hạt mang điện gấp đôi số hạt không mang điện
+ Phân tử CO 2 :
· Có số proton = số neutron = số electron = 6 + 8.2 = 22
· Khối lượng = (6.1 + 6.1) + 2.(8.1 + 8.1) = 44 amu
· Số hạt mang điện là 2.(6 + 8.2) = 44 = 22.2 → số hạt mang điện gấp đôi số hạt không mang điện
CH tr 5 2.9
Nguyên tử N có 7 proton, nguyên tử H có 1 proton. Số lượng hạt proton và electron có trong ion NH 4 + là
A. 11 proton và 10 electron. B. 11 proton và 11 electron.
C. 10 proton và 11 electron. D. 10 proton và 10 electron.
Phương pháp giải:
Dựa vào:
- Số neutron và proton trong nguyên tử và ion của nguyên tử đó không thay đổi
- Số electron trong nguyên tử và ion có sự thay đổi
+ Ion dương bao nhiêu thì số electron trong ion giảm đi bấy nhiêu so với số electron trong nguyên tử
+ Ion âm bao nhiêu thì số electron trong ion tăng lên bấy nhiêu so với số electron trong nguyên tử
Lời giải chi tiết:
- Tổng số proton trong phân tử NH 4 + = 7.1 + 1.4 = 11 proton
- Tổng số electron trong phân tử NH 4 + = số proton - 1 = 11 - 1 = 10 electron
→ Đáp án: A
CH tr 6 2.10
Một bạn học sinh muốn xây dựng một mô hình nguyên tử hydrogen cỡ lớn theo đúng tỉ lệ để trưng bày trong hội chợ khoa học ở trường. Nếu nguyên tử có đường kính 1,00 m thì học sinh đó phải xây dựng hạt nhân có kích thước là bao nhiêu? Điều đó có dễ dàng thực hiện với các công cụ thông thường không? Mô hình đó có phù hợp để quan sát bằng mắt thường không? Biết rằng kích thước hạt nhân bằng 10 -5 lần kích thước nguyên tử.
Phương pháp giải:
Tính độ dài đường kính hạt nhân nguyên tử từ đó rút ra kết luận
Lời giải chi tiết:
- Đường kính hạt nhân nguyên tử trong mô hình = 1.10 -5 = 10 -5 m = 0,01 mm.
→ 0,01 mm rất nhỏ nên mô hình hạt nhân nguyên tử này không thể chế tạo được bằng dụng cụ thông thường và không phù hợp để quan sát được bằng mắt thường.
CH tr 6 2.11
Bán kính của hạt nhân nguyên tử carbon và bán kính nguyên tử carbon lần lượt là khoảng 2,7 fm (femtômét) và khoảng 70 pm (picômét). Tính thể tích của hạt nhân và thể tích của loại nguyên tử carbon đó theo đơn vị m 3 . Hãy cho biết phần trăm thể tích nguyên tử carbon bị chiếm bởi hạt nhân.
Biết rằng 1 fm = 10 -15 m, 1 pm = 10 -12 m.
Phương pháp giải:
Dựa vào
- Công thức tính thể tích hình cầu là \(V = \frac{{4\pi {r^3}}}{3}\)
Lời giải chi tiết:
- Có 2,7 fm = 2,7.10 -15 m, 70 pm = 7.10 -11 m
- Thể tích của hạt nhân nguyên tử là: \({V_{hat\,nhan}} = \frac{{4\pi {{(2,{{7.10}^{ - 15\;}})}^3}}}{3} = 8,{24.10^{ - 44\;}}({m^3})\)
- Thể tích của nguyên tử là: \({V_{nguyen\,tu}} = \frac{{4\pi {{({{7.10}^{ - 11\;}})}^3}}}{3} = 1,{44.10^{ - 30\;}}({m^3})\)
- Phần trăm thể tích nguyên tử carbon bị chiếm bởi hạt nhân là:
\(\frac{{8,{{24.10}^{ - 44\;}}}}{{1,{{44.10}^{ - 30\;}}}}.100\% = 5,{72.10^{ - 12}}\% \)
CH tr 6 2.12
Trái Đất có bán kính khoảng 6 371 km, được coi như gồm x nguyên tử hình cầu sắp xếp chặt khít cạnh nhau. Bán kính của Trái Đất sẽ thay đổi như thế nào nếu giả thiết chỉ còn x hạt nhân nguyên tử sắp xếp chặt khít cạnh nhau trong một khối cầu? Coi kích thước hạt nhân bằng 10 -5 lần kích thước nguyên tử.
Phương pháp giải:
Dựa vào kích thước hạt nhân bằng 10 -5 lần kích thước nguyên tử → Tính kích thước hạt nhân → Tính bán kính nguyên tử mới của Trái Đất
Lời giải chi tiết:
- Nếu giả thiết chỉ còn x hạt nhân nguyên tử sắp xếp chặt khít cạnh nhau trong một khối cầu thì bán kính mới của Trái Đất là: 6 371.10 -5 = 0,06371 km = 63,71 m.
→ Bán kính Trái Đất khi đó nhỏ đi 10 -5 lần.
CH tr 6 2.13
Sao neutron là một dạng trong một số khả năng kết thúc của quá trình tiến hoá sao. Sao neutron được hình thành khi một ngôi sao lớn hết nhiên liệu và sụp đổ. Các ngôi sao neutron trong vũ trụ được cấu tạo chủ yếu từ các hạt neutron. Giả sử bán kính của neutron là khoảng 1,0.10 -13 cm.
a) Tính khối lượng riêng của neutron, coi neutron có dạng hình cầu.
b) Giả sử một ngôi sao neutron có cùng khối lượng riêng với neutron, hãy tính khối lượng (theo kg) của một mảnh ngôi sao neutron có kích thước bằng một hạt cát hình cầu với bán kính 0,10 mm.
Phương pháp giải:
Dựa vào:
- \({m_{neutron}} \approx 1u \approx 1,{6605.10^{ - 27}}kg\)
- Công thức tính khối lượng riêng: \(d = \frac{m}{V}\)
- Công thức tính thể tích hình cầu là \(V = \frac{{4\pi {r^3}}}{3}\)
Lời giải chi tiết:
a) - Thể tích của neutron là: \(V = \frac{{4\pi {{(1,{{0.10}^{ - 13\;}})}^3}}}{3} = 4,{189.10^{ - 39\;}}(c{m^3}) = 4,{189.10^{ - 45\;}}({m^3})\)
- Khối lượng riêng của neutron là: \(d = \frac{m}{V} = \frac{{1,{{6605.10}^{ - 27}}}}{{4,{{189.10}^{ - 45\;}}}} = 3,{964.10^{17}}(kg/{m^3})\)
b) - Thể tích của sao neutron là: \(V = \frac{{4\pi {{(0,1)}^3}}}{3} = 4,{189.10^{ - 3\;}}(m{m^3}) = 4,{189.10^{ - 12}}({m^3})\)
- Khối lượng của sao neutron là: \(m = d.V = 3,{964.10^{17}}.4,{189.10^{ - 12}} = 1,{6605.10^6}(kg)\)
CH tr 6 2.14
Vào những ngày hanh khô, cơ thể chúng ta có thể tích tụ điện tích khi đi bộ trên một số loại thảm hoặc khi chải tóc. Giả sử cơ thể chúng ta tích một lượng điện tích là -10 μC (micrôculông).
a) Hãy cho biết trong trường hợp này, cơ thể chúng ta đã nhận thêm hay mất đi electron.
b) Tổng khối lượng của các electron mà cơ thể đã nhận thêm hoặc mất đi là bao nhiêu kilôgam? Cho khối lượng của 1 electron là 9,1.10 -31 kg.
Biết rằng 1 μC = 10 -6 C.
Phương pháp giải:
a) Vì cơ thể tích một lượng điện tích âm " cơ thể nhận thêm electron.
b) - Số lượng electron ứng với điện tích -10 μC (micrôculông) là:
\(\frac{{ - {{10.10}^{ - 6}}}}{{ - 1,{{602.10}^{ - 19}}\;}} = 6,{242.10^{13}}(electron)\)
- Tổng khối lượng electron là: 9,1.10 -31 .6,242.10 13 = 5,68 .10 -17 (kg).
CH tr 6 2.15
Trong thí nghiệm của Rutherford, khi sử dụng các hạt alpha (ion He 2+ , kí hiệu là α) bắn vào lá vàng thì:
- Hầu hết các hạt α xuyên thẳng qua lá vàng.
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu.
- Một số rất ít hạt α bị bật ngược trở lại.
Từ kết quả này, em có nhận xét gì về cấu tạo nguyên tử?
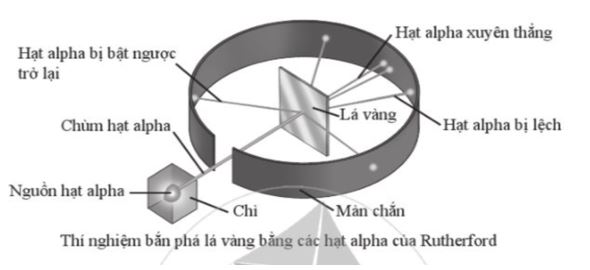
Lời giải chi tiết:
Trong thí nghiệm của Rutherford, khi sử dụng các hạt alpha (ion He 2+ , kí hiệu là α) bắn vào lá vàng thì:
- Hầu hết các hạt α xuyên thẳng qua lá vàng => nguyên tử có cấu tạo rỗng
- Một số ít hạt α bị lệch quỹ đạo so với ban đầu => hạt nhân nguyên tử cùng điện tích dương như hạt alpha (ion He 2+ , kí hiệu là α)
- Một số rất ít hạt α bị bật ngược trở lại => kích thước hạt nhân nhỏ hơn rất nhiều so với kích thước của nguyên tử và khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.