Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạo
Cấu hình electron nào của nguyên tử halogen? Dung dịch AgNO3 không tác dụng với dung dịch.
7.1
Cấu hình electron nào của nguyên tử halogen?
A. 1s 2 2s 2 2p 6 .
B. 1s 2 2s 2 2p 6 3s 2 .
C. 1s 2 2s 2 2p 6 3s 2 3p 5 .
D. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 .
Phương pháp giải:
Dựa vào các nguyên tử halogen thuộc nhóm VIIA -> Có 7 electron ở lớp ngoài cùng
Lời giải chi tiết:
- Đáp án: C
7.2
Dung dịch AgNO 3 không tác dụng với dung dịch.
A. NaI.
B. NaF.
C. NaCl.
D. NaBr
Phương pháp giải:
Dựa vào tính tan của các muối halide với ion Ag +
Lời giải chi tiết:
- Đáp án: B
- Giải thích: Do AgF là một muối tan
|
Halide ion Thuốc thử |
F - |
Cl - |
Br - |
I - |
|
Dung dịch AgNO 3 |
Không hiện tượng |
Có kết tủa trắng (AgCl) |
Có kết tủa vàng nhạt (AgBr) |
Có kết tủa vàng (AgI) |
7.3
Phương trình hoá học nào viết sai?
A. Br 2 + Cu → CuBr 2
B. 2HCl + Na 2 CO 3 → 2NaCl + H 2 O + CO 2
C. NaBr + AgNO 3 → AgBr + NaNO 3
D. Cl 2 + Fe → FeCl 2
Phương pháp giải:
A. Tính oxi hóa của Br 2
B. Tính acid của HCl
C. Tính tan của muối Br -
D. Tính oxi hóa của Cl 2
Lời giải chi tiết:
- Đáp án: D
- Giải thích: Cl 2 có tính oxi hóa mạnh, sẽ oxi hóa Fe từ 0 lên Fe có số oxi hóa +3
3Cl 2 + 2Fe → 2FeCl 3
7.4
Nước chlorine có tính tẩy màu là do:
A. HCl có tính acid mạnh.
B. Cl 2 vừa có tính khử vừa có tính oxi hoá.
C. HClO có tính oxi hoá mạnh.
D. Cl 2 có tính oxi hoá mạnh.
Phương pháp giải:
Dựa vào thành phần có trong nước chlorine và tính oxi hóa của các thành phần có trong nước chlorine
Lời giải chi tiết:
- Ta có: Cl 2 + H 2 O HCl + HClO
- Trong thành phần của nước chlorine, HClO là một chất có tính oxi hóa mạnh
=> Đáp án: C
7.5
Halogen không có tính khử là
A. fluorine.
B. bromine.
C. iodine.
D. chlorine.
Phương pháp giải:
- Fluorine chỉ có tính oxi hóa
- Chlorine, Bromine và Iodine vừa có tính oxi hóa, vừa có tính khử
Lời giải chi tiết:
- Đáp án: A, do fluorine có độ âm điện lớn nhất nên trong hợp chất, fluorine luôn có số oxi hóa -1 => Chỉ mang tính oxi hóa
7.6
Phương trình hoá học của 2 phản ứng như sau:
Cl 2 + 2NaBr → 2NaCl + Br 2
Br 2 + 2NaI → 2NaBr + I 2
So sánh tính khử của các ion halide qua 2 phản ứng. Giải thích
Phương pháp giải:
Dựa vào tính chất trong phản ứng oxi hóa khử:
Chất khử mạnh + Chất oxi hóa mạnh " Chất oxi hóa yếu + Chất khử yếu
Lời giải chi tiết:
- Trong phản ứng: \(\mathop {C{l_2}}\limits^0 + 2Na\mathop {Br}\limits^{ - 1} \to 2Na\mathop {Cl}\limits^{ - 1} + \mathop {B{r_2}}\limits^0 \) ta có ion Br - là chất khử
=> Tính khử: Br - > Cl -
- Trong phản ứng: \(\mathop {B{r_2}}\limits^0 + 2Na\mathop I\limits^{ - 1} \to 2Na\mathop {Br}\limits^{ - 1} + \mathop {{I_2}}\limits^0 \) ta có ion I - là chất khử
=> Tính khử: I - > Br -
=> So sánh tính khử của các ion halide: I - > Br - > Cl -
7.7
Ghi hiện tượng vào các ô trống trong bảng và viết phương trình hoá học của phản ứng (nếu có).

Phương pháp giải:
- Tính oxi hóa của các halogen giảm dần theo thứ tự: F 2 > Cl 2 > Br 2 > I 2
- Nước chlorine có tính oxi hóa mạnh
Lời giải chi tiết:
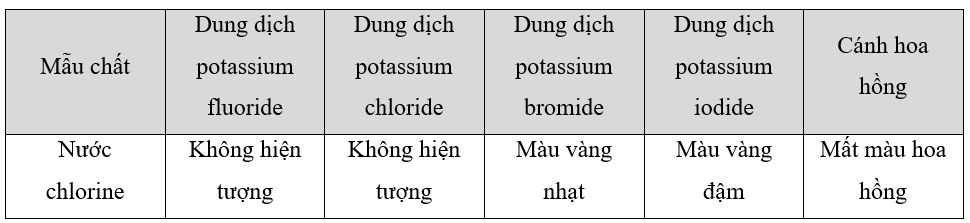
Các phương trình xảy ra:
Cl 2 + 2KBr -> 2KCl + Br 2
Cl 2 + 2KI -> 2KCl + I 2
Cl 2 + H 2 O HCl + HClO (HClO có tính oxi hóa mạnh làm mất màu hoa hồng)
7.8
Chlorine tạo được các acid có oxygen trong thành phần phân tử. Tên và công thức của các acid có oxygen của chlorine theo bảng.
|
HClO |
Hypo chlor ous acid |
ClO - |
Hypo chlor ite |
|
HClO 2 |
Chlor ous acid |
ClO 2 - |
Chlor ite |
|
HClO 3 |
Chlor ic acid |
ClO 3 - |
Chlor ate |
|
HClO 4 |
Per chlor ic acid |
ClO 4 - |
Per chlor ate |
Acid có hậu tố -ous thì tạo muối có hậu tố -ite; acid có hậu tố -ic tạo muối có hậu tố -ate; acid có mức oxi hoá của nguyên tố trung tâm thấp nhất có tiền tố hypo- acid có mức oxi hoá của nguyên tố trung tâm cao nhất có tiền tổ per-. Áp dụng quy tắc trên, đọc tên các chất sau: HBrO; HBrO 2 ; HBrO 3 ; HBrO 4 ; NaBrO: KBгO 2 ; KBrO 3 và KBгO 4 .
Lời giải chi tiết:
|
HBrO |
Hypo bromr ous acid |
NaBrO |
Sodium hypo brom ite |
|
HBrO 2 |
Brom ous acid |
KClO 2 |
Potassium brom ite |
|
HBrO 3 |
Brom ic acid |
KClO 3 |
Potassium brom ate |
|
HBrO 4 |
Per brom ic acid |
KClO 4 |
Potassium per brom ate |
7.9
Nghiền mịn 10 g một mẫu đá vôi trong tự nhiên, hoà tan trong lượng dư dung dịch HCl thu được 4 g khí carbonic. Tính hàm lượng calcium carbonate trong mẫu đá vôi.
Phương pháp giải:
- Tính số mol khí carbonic -> số mol calcium carbonate phản ứng -> Tính hàm lượng calcium carbonate trong mẫu đá vôi
Lời giải chi tiết:
- Có \({n_{C{O_2}}} = \frac{4}{{44}} = 0,091\)mol
- Ta có phương trình:
CaCO 3 + 2HCl -> CaCl 2 + CO 2 + H 2 O
0,091 <- 0,091 mol
- Hàm lượng calcium carbonate trong mẫu đá vôi là:
\(\% {m_{CaC{O_3}}} = \frac{{0,091.100}}{{10}}.100\% = 90,91\% \)