Bài 15. Các phương pháp tách kim loại trang 99, 100 SBT Hóa 12 Chân trời sáng tạo
Nguyên tắc tách kim loại là
15.1
Nguyên tắc tách kim loại là
A. khử ion kim loại. B. oxi hóa ion kịm loại thành nguyên tử.
C. khử nguyên tử kim loại thành ion. D. oxi hóa nguyên tử kim loại thành ion.
Phương pháp giải:
Dựa vào nguyên tắc tách kim loại.
Lời giải chi tiết:
Nguyên tắc tách kim loại là khử ion kim loại.
Đáp án A
15.2
Kim loại nào sau đây được điều chế bằng phương pháp thủy luyện?
A. Cu. B. Na. C. Ca. D. Mg.
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Phương pháp thủy luyện để tách kim loại trung bình và yếu: Cu, Fe, Ag.
Đáp án A
15.3
Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Fe. B. Na. C. Cu. D. Ag.
Phương pháp giải:
Phương pháp điện phân nóng chảy để tách các kim loại mạnh
Lời giải chi tiết:
Na là kim loại mạnh nên được điều chế bằng phương pháp điện phân nóng chảy.
Đáp án B
15.4
Phương pháp chung để điều chế các kim loại Na, Ca, Al trong công nghiệp là
A. điện phân dung dịch. B. điện phân nóng chảy.
C. nhiệt luyện. D. thủy luyện.
Phương pháp giải:
Dựa vào tính mạnh yếu của kim loại để xác định phương pháp điều chế.
Lời giải chi tiết:
Na, Ca, Al là các kim loại mạnh nên được điều chế bằng phương pháp điện phân nóng chảy.
Đáp án B
15.5
Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại có thể được điều chế bằng phương pháp điện phân dung dịch (với điện cực trơ) là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Dựa vào tính mạnh yếu của kim loại để xác định phương pháp điều chế.
Lời giải chi tiết:
Phương pháp điện phân dung dịch với điện cực trơ để tách các kim loại mạnh: K, Ba.
Đáp án B
15.6
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện là
A. Mg. B. Fe. C. Na. D. Al.
Phương pháp giải:
Phương pháp nhiệt luyện để tách các kim loại trung bình.
Lời giải chi tiết:
Fe là kim loại trung bình nên được điều chế bằng phương pháp nhiệt luyện.
Đáp án B
15.7
Dãy gồm các kim loại có thể điều chế được bằng phương pháp nhiệt luyện là
A. Al, Na, Ba. B. Ca, Ni, Zn. C. Mg, Fe, Cu. D. Fe, Cr, Zn.
Phương pháp giải:
Phương pháp nhiệt luyện để tách các kim loại trung bình.
Lời giải chi tiết:
Fe, Cr, Zn là các kim loại trung bình.
Đáp án D
15.8
Trong công nghiệp, Mg có thể được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl 2 . B. Cho kim loại Zn vào dung dịch MgCl 2 .
C. Điện phân dung dịch MgSO 4 . D. Cho kim loại Na vào dung dịch Mg(NO 3 ) 2 .
Phương pháp giải:
Dựa vào mức độ kim loại để xác định phương pháp điều chế.
Lời giải chi tiết:
Mg là kim loại mạnh nên điện phân nóng chảy MgCl 2 để điều chế Mg.
Đáp án A
15.9
Cho luồng khí CO dư qua hỗn hợp các oxide CuO, Fe 2 O 3 , Al 2 O 3 , MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al, Mg. B. Cu, FeO, Al 2 O 3 , MgO.
C. Cu, Fe, Al 2 O 3 , MgO. D. Cu, Fe, Al, MgO.
Phương pháp giải:
Các kim loại đứng sau Al bị khử bởi CO.
Lời giải chi tiết:
CuO, Fe 2 O 3 bị khử bởi CO dư thu được Cu, Fe.
Al 2 O 3 , MgO không bị khử
Hỗn hợp rắn thu được Cu, Fe, Al 2 O 3 , MgO.
Đáp án C
15.10
Cho phương trình hóa học của phản ứng sau:
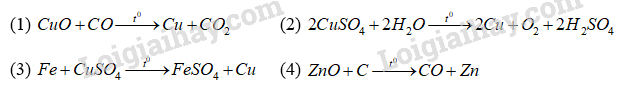
Số phản ứng có thể được dùng để điều chế kim loại bằng phương pháp nhiệt luyện là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện.
Lời giải chi tiết:
Phản ứng (1) và (4) có thể được dùng để điều chế kim loại bằng phương pháp nhiệt luyện.
Đáp án B
15.11
Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO 3 .
(2) Cho Fe vào dung dịch Fe 2 (SO 4 ) 3 .
(3) Cho Na vào dung dịch CuSO 4 .
(4) Dẫn khí CO (dư) qua ống nghiệm có bột CuO, nung nóng.
Các thí nghiệm tạo thành đơn chất kim loại sau phản ứng là
A. (3) và (4). B. (1) và (2). C. (2) và (3). D. (1) và (4).
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
(1) tạo kim loại Ag.
(2) không tạo ra kim loại
(3) tạo kết tủa Cu(OH) 2
(4) tạo kim loại Cu
Đáp án D
15.12
Một hỗn hợp kim loại gồm bạc, sắt và kẽm. Dung dịch nào sau đây có thể dùng để loại bỏ sắt và kẽm trong hỗn hợp nêú với mục đích thu được bạc?
A. Dung dịch CuSO 4 . B. Dung dịch FeCl 2 . C. Dung dịch ZnSO 4 . D. Dung dịch HCl.
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Dùng dung dịch HCl để loại bỏ sắt và kẽm vì Fe và Zn phản ứng với HCl; Ag không phản ứng.
Đáp án D
15.13
Để làm tinh khiết một loại bột đồng có lẫn bột các kimn loại thiếc, kẽm, chì, người ta cho hỗn hợp này vào dung dịch copper (II) nitrate dư. Giải thích và viết phương trình hóa học của phản ứng xảy ra (nếu có).
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Khi ngâm đồng lẫn các tạp chất kẽm, thiếc, chì trong dung dịch Cu(NO 3 ) 2 dư, các tạp chất bị hòa tan, tạo thành dung dịch các muối và kim loại đồng. Lọc bỏ dung dịch, thu được kim loại đồng.
Phương trình hóa học của các phản ứng:
\(\begin{array}{l}Sn + Cu{(N{O_3})_2} \to Sn{(N{O_3})_2} + Cu\\Zn + Cu{(N{O_3})_2} \to Zn{(N{O_3})_2} + Cu\\Pb + Cu{(N{O_3})_2} \to Pb{(N{O_3})_2} + Cu\end{array}\)
15.14
Hòa tan hoàn toàn hỗn hợp A gồm CuO, Fe 2 O 3 , Mg vào dung dịch HCl dư thu được dung dịch X. Cho dung dịch NaOH đến dư vào dung dịch X, thu được kết tủa Y. Lọc để lấy kết tủa Y, nung trong không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn Z. Dẫn khí CO dư qua chất rắn Z (nung nóng). Sau khi phản ứng hoàn toàn, chất rắn thu được gồm những chất nào? Viết phương trình hóa học của các phản ứng xảy ra (nếu có).
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Phương trình hóa học của các phản ứng xảy ra:
\(\begin{array}{l}CuO + 2HCl \to CuC{l_2} + {H_2}O\\F{e_2}{O_3} + 6HCl \to 2FeC{l_3} + 3{H_2}O\\Mg + 2HCl \to MgC{l_2} + {H_2}\end{array}\)
Dung dịch X gồm: HCl, CuCl 2 , FeCl 3 , MgCl 2 .
Phương trình hóa học của các phản ứng xảy ra khi cho NaOH đến dư vào ung dịch X:
\(\begin{array}{l}HCl + NaOH \to NaCl + {H_2}O\\CuC{l_2} + 2NaOH \to 2NaCl + Cu{(OH)_2}\\FeC{l_3} + 3NaOH \to 3NaCl + Fe{(OH)_3}\\MgC{l_2} + 2NaOH \to 2NaCl + Mg{(OH)_2}\end{array}\)
Kết tủa Y gồm: Cu(OH) 2 , Fe(OH) 3 , Mg(OH) 2 .
Phương trình hóa học của các phản ứng khi nung trong không khí hỗn hợp kết tủa Y:
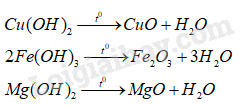
Chất rắn Z gồm: CuO, Fe 2 O 3 và MgO.
Phương trình hóa học của các phản ứng khi dẫn khí CO dư qua chất rắn Z (nung nóng):
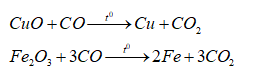
Hỗn hợp chất rắn thu được sau cùng gồm Cu, Fe và MgO.
15.15
Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy aluminium oxide với các điện cực làm bằng than chì, sử dụng cryolite (Na 3 AlF 6 ) nóng chảy làm xúc tác.
a) Viết các phương trình hóa học của phản ứng có thể xảy ra trong quá trình sản xuất nhôm.
b) Tính lượng quặng bauxite (chứa 80% Al 2 O 3 ) và lượng than chì cần dùng để sản xuất 2,7 tấn nhôm. Giả sử hiệu suất chế biến quặng và quá trình điện phân là 100%; khí thoát ra tại anode gồm 10% O 2 ; 10% CO và 80% CO 2 về thể tích.
Phương pháp giải:
Dựa vào các phương pháp tách chất.
Lời giải chi tiết:
a) Phương trình hóa học của các phản ứng có thể xảy ra trong quá trình sản xuất nhôm:

b) Theo đề, ta có:
\({n_{Al}} = \frac{{2,{{7.10}^3}}}{{27}} = 100\,(kmol)\)
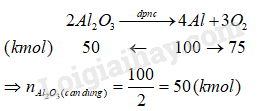
Lượng Al 2 O 3 cần dùng để sản xuất nhôm là
\({m_{A{l_2}{O_3}}} = 50.1022 = 5100\,(kg)\, = \,5,1\,\)(tấn)
Do quặng chứa 80% Al 2 O 3 , do đó khối lượng quặng cần dùng là
\(m = \frac{{5,1.100}}{{80}} = 6,375\,\)(tấn)
Tương tự, ta có số mol oxygen sinh ra là
\({n_{{O_2}}} = \frac{{3.100}}{4} = 75\,(kmol)\)
Gọi x là số mol oxygen phản ứng với C tạo sản phẩm CO, y là số mol oxygen phản ứng với C tạo sản phẩm CO 2 . Ta có:
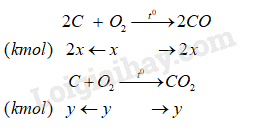
Trong hỗn hợp khí thoát ra chứa 2x (kmol) CO (10%); y kmol CO 2 (80%) và z mol O 2 dư (10%).
Ta có:
\(\left\{ \begin{array}{l}x + y + z = 75\\z = 2x\\y = 8z = 16x\end{array} \right. \Rightarrow \left\{ \begin{array}{l}2x = 7,895\\z = 7,895\\y = 63,158\end{array} \right.\)
Tương ứng là 7,895 kmol CO; 63,158 kmol CO 2 và 7,895 kmol O 2 .
\( \to \)n C (phản ứng) = 2x + y = 71,053 (kmol)
\( \to \)m C (phản ứng) =71,053. 12 = 852,636 (kg).