Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Biến thiên enthalpy của phản ứng hóa học
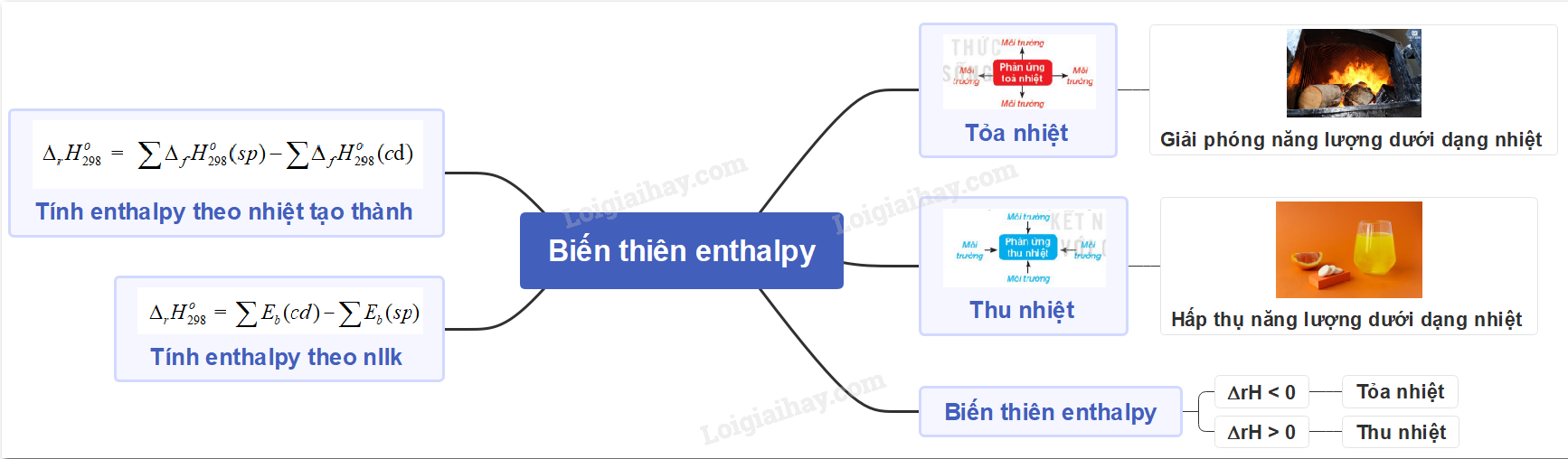
Lý thuyết: Tính biến thiên enthalpy của phản ứng hóa học
I. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Phản ứng hóa học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm
- Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất)
- Ở điều kiện chuẩn:
\({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\)

II. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
- Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ)
- Ở điều kiện chuẩn:
\({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\rm{d}})\)
- Lưu ý: Hệ số của các chất trong phương trình hóa học
Ví dụ: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS 2 (s) + 11O 2 (g) → 2Fe 2 O 3 (s) + 8SO 2 (g)
biết nhiệt tạo thành \({\Delta _f}H_{298}^o\) của các chất FeS 2 (s), Fe 2 O 3 (s) và SO 2 (g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol
Lời giải:

Sơ đồ tư duy: