Lý thuyết bài 8: Quy tắc octet
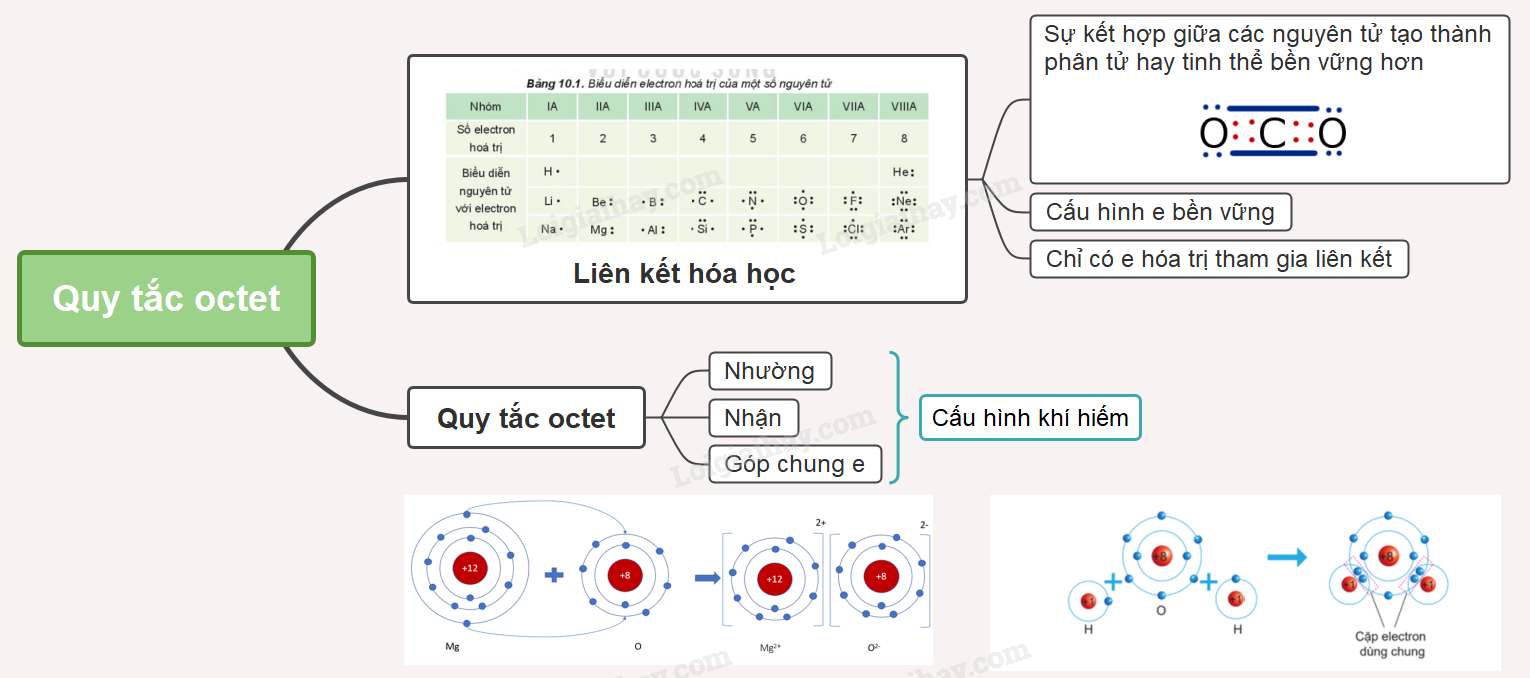
Quy tắc octet Liên kết hóa học
Lý thuyết: Quy tắc octet
I. Khái niệm liên kết hóa học
- Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
- Khi tạo thành liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm
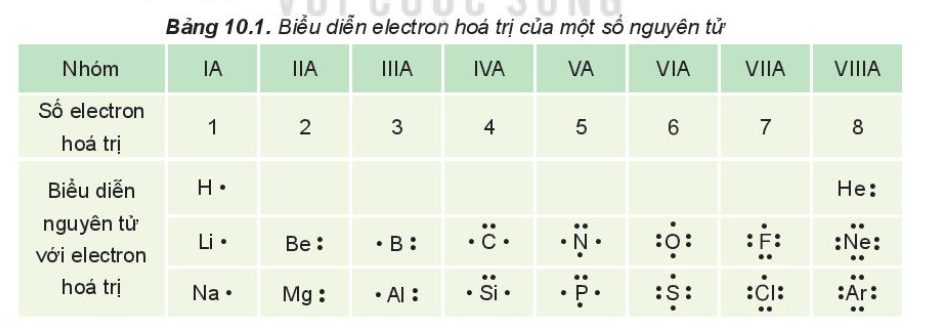
- Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết (electron hóa trị)
II. Quy tắc octet
- Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet
Ví dụ:
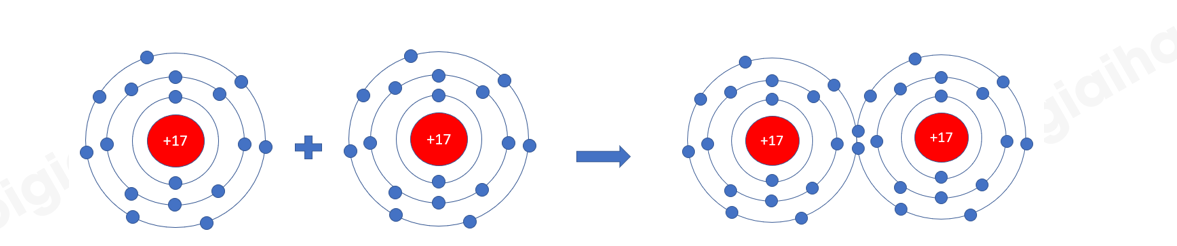
- Khi hình thành liên kết hóa học trong phân tử Cl 2 , nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
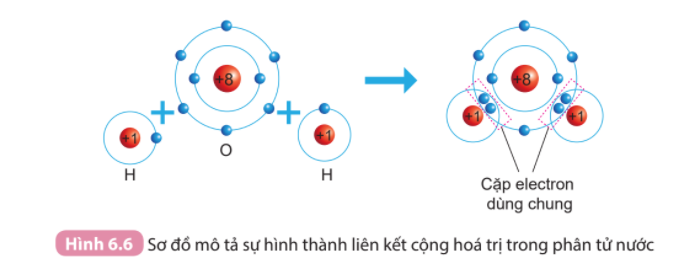
- Khi hình thành liên kết hóa học trong phân tử H 2 O, nguyên tử hydrogen có 1 electron hóa trị, nguyên tử oxygen có 6 electron hóa trị, mỗi nguyên tử hydrogen cần thêm 1 electron và nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hòa theo quy tắc octet.
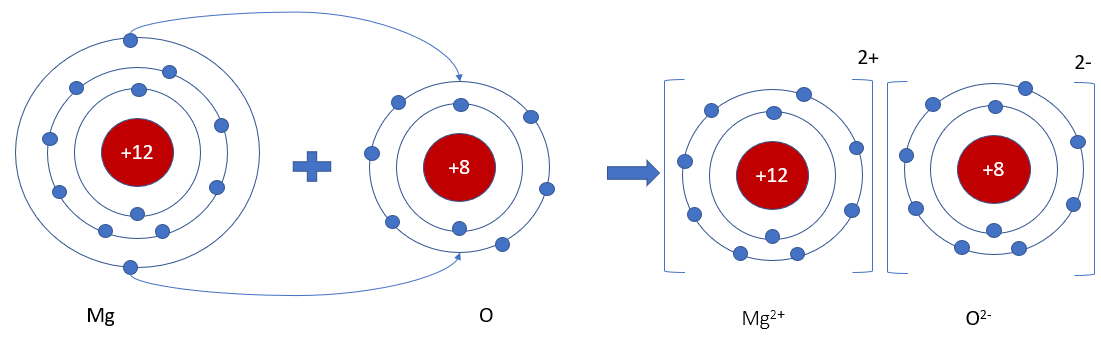
Khi hình thành liên kết hóa học trong phân tử MgO, nguyên tử Mg có 2 electron hóa trị, nguyên tử O có 6 electron háo trị, nguyên tử Mg nhường 2 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử O nhận 2 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau