Lý thuyết Sulfur và Sulfur dioxide - Hóa học 11 - Chân trời sáng tạo
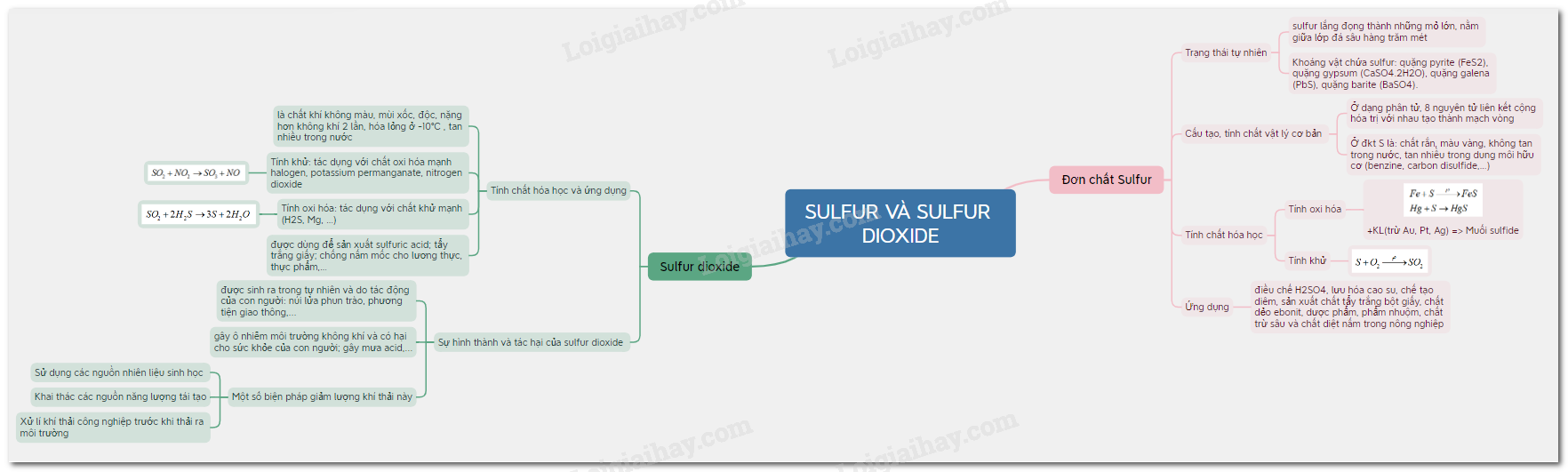
Đơn chất Sulfur - Sulfur dioxide
Bài 6:
SULFUR VÀ SULFUR DIOXIDE
1.Đơn chất Sulfur
a) Trạng thái tự nhiên:
- Trong tự nhiên, sulfur lắng đọng thành những mỏ lớn, nằm giữa lớp đá sâu hàng trăm mét.
- Khoáng vật trong tự nhiên chứa sulfur ở dạng hợp chất: quặng pyrite (FeS 2 ), quặng gypsum (CaSO 4 .2H 2 O), quặng galena (PbS), quặng barite (BaSO 4 ).
b) Cấu tạo, tính chất vật lý cơ bản của sulfur đơn chất
- Ở dạng phân tử, 8 nguyên tử liên kết cộng hóa trị với nhau tạo thành mạch vòng. Kí hiệu là S.
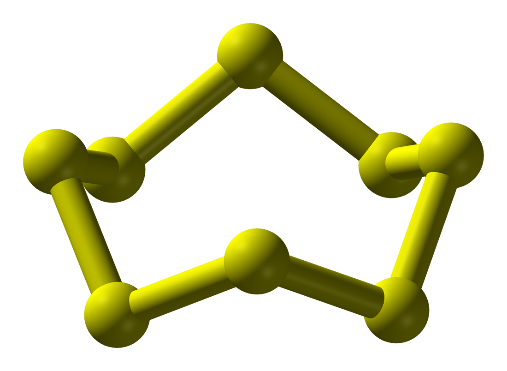
Hình 1: Phân tử sulfur ở điều kiện thường
-Ở điều kiện thường sulfur là: chất rắn, màu vàng, không tan trong nước, tan nhiều trong dung môi hữu cơ (benzine, carbon disulfide,…)
c) Tính chất hóa học
- Tính oxi hóa: sulfur oxi hóa được nhiều kim loại (trừ Au, Pt, Ag) ở nhiệt độ cao -> Muối sulfide
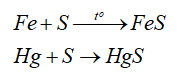
-Tính khử:
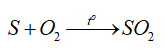
d) Ứng dụng:
- Sulfur có nhiều ứng dụng như: điều chế H 2 SO 4 , lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,…
2. Sulfur dioxide
a) Tính chất hóa học và ứng dụng
- SO 2 là chất khí không màu, mùi xốc, độc, nặng hơn không khí 2 lần, hóa lỏng ở -10℃ , tan nhiều trong nước.
- Tính khử: SO 2 là chất khử khi tác dụng với chất oxi hóa mạnh (halogen, potassium permanganate, nitrogen dioxide,…)
\(S{O_2} + N{O_2} \to S{O_3} + NO\)
-Tính oxi hóa: SO 2 là chất oxi hóa khi tác dụng với chất khử mạnh (H 2 S, Mg, …)
\(S{O_2} + 2{H_2}S \to 3S + 2{H_2}O\)
-Sulfur dioxide được dùng để sản xuất sulfuric acid; tẩy trắng giấy; chống nấm mốc cho lương thực, thực phẩm,…
b) Sự hình thành sulfur dioxide, tác hại của sulfur dioxide và một số biện pháp giảm thiểu lượng sulfur dioxide thải vào không khí
- Sulfur dioxide được sinh ra trong tự nhiên và do tác động của con người

-Sulfur dioxide là một trong các chất chủ yếu gây ô nhiễm môi trường không khí và có hại cho sức khỏe của con người; sự phát thải SO 2 vào bầu khí quyển cũng là một trong những nguyên nhân gây mưa acid.
-Một số biện pháp giảm lượng khí thải này:
+ Sử dụng các nguồn nhiên liệu sinh học thân thiện với môi trường thay cho nguồn năng lượng hóa thạch.
+ Khai thác các nguồn năng lượng tái tạo như: năng lượng mặt trời, năng lượng gió, mưa, sóng biển,…
+ Xử lí khí thải công nghiệp trước khi thải ra môi trường.
Sơ đồ tư duy bài Sulfur và Sulfur dioxide