Tổng hợp 7 đề thi giữa kì 1 Hóa 11 Kết nối tri thức có đáp án
Tải vềĐiều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học
Đề 1
I. Trắc nghiệm (6 điểm)
Câu 1: Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?
A. Nồng độ của các sản phẩm sẽ không thay đổi vì không còn chất phản ứng
B. Nồng độ của sản phẩm sẽ không thay đổi vì chất tham gia phản ứng đã hết
Câu 3: Cho hai phản ứng sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\)
(2) \(HI(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g)\)
Biết hằng số cân bằng của (1) bằng 6. Giá trị hằng số cân bằng K C2 của phản ứng: \(HI(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g)\)
A. 0,408 B. 2,454 C. 0,167 D. 36
C. Nồng độ của các sản phẩm sẽ không thay đổi vì tốc độ phản ứng thuận và nghịch bằng nhau
D. Nồng độ của các sản phẩm sẽ thay đổi liên tục do tính thuận nghịch
Câu 2: Biểu thức biểu diễn hằng số cân bằng Kc là: \(A + B \to C + D\)
\(A.{K_c} = \frac{{{\rm{[}}A].{\rm{[}}B{\rm{]}}}}{{{\rm{[}}C{\rm{]}}.{\rm{[}}D{\rm{]}}}}\)
\(\begin{array}{l}B.{K_C} = \frac{{{\rm{[}}C{\rm{]}}.{\rm{[}}D{\rm{]}}}}{{{\rm{[}}A].{\rm{[}}B{\rm{]}}}}\\C.{K_C} = \frac{{{\rm{[}}A].{\rm{[}}B{\rm{]}}}}{{{\rm{[}}C{\rm{]}}}}\\D.{K_C} = \frac{{{\rm{[}}C{\rm{]}}}}{{{\rm{[}}A].{\rm{[}}B{\rm{]}}}}\end{array}\)
Câu 4 : Dãy chất gồm các chất điện ly mạnh
A. KOH, C 2 H 5 OH, H 2 CO 3 , MgCl 2
B. NaOH, HCl, Ba(NO 3 ) 2 , H 2 O
C. NH 3 , H 2 S, H 2 O, HCl
D. HCl, K 2 SO 4 , H 2 SO 4 , Ca(OH) 2
Câu 5: Trong các phản ứng dưới đây, hãy cho biết ở phản ứng nào nước đóng vai trò là base theo thuyết Brønsted - Lowry:
(1) \(HCl + {H_2}O \to {H_3}{O^ + } + C{l^ - }\)
(2) \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
(3) \(C{H_3}COOH + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_3}{O^ + } + C{H_3}CO{O^ - }\)
(4) \(CO_3^{2 - } + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - + O{H^ - }\)
A. 1,2 B. 1, 3 C. 2,4 D. 3, 4
Câu 6: Xét phản ứng thuận nghịch: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\). Cho các phát biểu sau:
(a) Biểu thức hằng số cân bằng của phản ứng trên là: \({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{\rm{[}}S{O_2}].{\rm{[}}{O_2}]}}\)
(b) Tại thời điểm cân bằng, hỗn hợp có chứa SO 2 , O 2 , SO 3
(c) Theo thời gian, nồng độ SO 2 , O 2 tăng dần, nồng độ SO 3 giảm dần để đạt được trạng thái cân bằng
(d) Khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận
Số phát biểu đúng là
A. 2 B. 3 C. 4 D. 1
Câu 7: Dung dịch nào sau đây có pH > 7?
A. HCl B. KNO 3 C. NH 4 Cl D. Na 2 CO 3
Câu 8: Tính pH của dung dịch sau khi trộn 200ml dung dịch NaOH 0,1M và 100ml dung dịch Ca(OH) 2 0,2M.
A. 0,69 B. 13,3 C. 1 D. 14
Câu 9: Cho các phân tử và ion sau: \(HI,C{H_3}COO - ,{H_2}PO_4^ - ,PO_4^{3 - },N{H_3},{S^{2 - }},HPO_4^{2 - }\)
Hãy cho biết có bao nhiêu phân tử, ion lưỡng tính theo thuyết Bronsted – Lowry
A. 4 B. 3 C. 2 D. 1
Câu 10: Nitrogen thể hiện tính khử trong phản ứng nào?
A. \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}\)
B. \({N_2} + {O_2} \to 2NO\)
C. \({N_2} + 3Mg \to M{g_3}{N_2}\)
D. \({N_2} + 6Li \to 2L{i_3}N\)
Câu 11: Trong phòng thí nghiệm, người ta có thể phân biệt muối ammonium với một số muối khác bằng cách cho nó tác dụng với dung dịch base. Hiện tượng nào xảy ra?
A. Thoát ra một chất khí màu lục nhạt, làm xanh giấy quỳ tím ẩm.
B. Thoát ra một chất khí không màu, làm xanh giấy quỳ tím ẩm.
C. Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm.
D. Thoát ra một chất khí không màu, làm hồng giấy quỳ tím ẩm.
Câu 12: Trong khí thải của quy trình sản xuất thuốc trừ sâu, phân bón hoá học có lẫn khí NH 3 . Khí này rất độc đối với sức khoẻ của con người và gây ô nhiễm môi trường. Con người hít phải khí này với lượng lớn sẽ gây ngộ độc: họ, đau ngực (nặng), đau thắt ngực, khó thở, thở nhanh, thở khò khè; chảy nước mắt và bỏng mắt, mù mắt, đau họng nặng, đau miệng; mạch nhanh, yếu, sốc; lẫn lộn, đi lại khó khăn, chóng mặt, thiếu sự phối hợp, bồn chồn, ngẩn ngơ). Để xử lí NH 3 lẫn trong khí thải, người ta có thể dẫn khí thải qua một bể lọc chứa hoá chất nào sau đây?
A. Dung dịch Ca(OH) 2 . B. Dung dịch HCl.
C. Dung dịch NaOH. D. Nước.
Câu 13: Tính pH của dung dịch sau khi trộn 100ml dung dịch HCl 0,5M vào 100ml dung dịch Ba(OH) 2 0,1M
A. 12,5 B. 0,82 C. 7 D.13
Câu 14: Tính base của NH 3 do:
A. Cặp e tự do của nguyên tử nitrogen
B. Phân tử có 3 liên kết cộng hóa trị phân cực
C. NH 3 tan nhiều trong nước
D. NH 3 tác dụng với nước tạo NH 4 OH
Câu 15: Khí không màu hóa nâu trong không khí là
A. N 2 O B. NO C. NH 3 D. NO 2
II. Tự luận ( 4 điểm)
Câu 1 (2 điểm): Trộn 300ml dung dịch KOH a(M) vào 200ml dung dịch HCl 0,2M thu được dung dịch có pH = 13. Tính a(M)
Câu 2 (2 điểm): Nung hỗn hợp A gồm 3,7185 lít N 2 và 7,437 lít H 2 với xúc tác thích hợp. Thể tích hỗn hợp khí thu được sau phản ứng là 8,1807 lít (các khí ở đo ở điều kiện chuẩn). Tính hiệu suất của phản ứng trên?
----Hết----
Đề 2
I. Trắc nghiệm (6 điểm)
Câu 1: Phản ứng thuận nghịch là:
A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
B. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
C. Phản ứng trong đó ở cùng điều kiện, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
D. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Câu 2: Cho phản ứng: \(CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(g)\) \({\Delta _r}H_{298}^0 > 0\)
Cân bằng phản ứng trên dịch chuyển theo chiều thuận khi
A. Giảm nhiệt độ
B. Tăng áp suất
C. Giảm nồng độ CO 2
D. Thêm chất xúc tác
Câu 3: Hằng số cân bằng K C của phản ứng chỉ phụ thuộc vào:
A. Nhiệt độ
B. Xúc tác
C. Nồng độ
D. Áp suất
Câu 4: Theo thuyết Bronsted – Lowry về acid – base, những chất có khả năng nhận H+ là:
A. acid B. base C. lưỡng tính D. muối
Câu 5: Trong dung dịch acid acetic (bỏ qua sự phân li của H 2 O) có những phần tử nào?
A. CH 3 OO - , H +
B. CH 3 COOH, H 2 O
C. CH 3 COOH, H + , H 2 O
D. CH 3 COO - , H + , H 2 O, CH 3 COOH
Câu 6: Cho phương trình: \(NH_4^ + + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3} + {H_3}{O^ + }\). Phát biểu nào sau đây là đúng?
A. NH 4 + là base
B. NH 4 + là acid
C. H 2 O là acid
D. H 3 O + là base
Câu 7: Trộn 200ml dung dịch H 2 SO 4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là:
A. 1,3 B. 4 C. 1 D. 3
Câu 8: Chuẩn độ 10ml dung dịch H 2 SO 4 chưa biết nồng độ đã dùng hết 20ml dung dịch KOH 0,1M. Nồng độ mol của dung dịch H 2 SO 4 là:
A. 0,2M B. 0,05M C. 0,1M D. 0,15M
Câu 9: Công thức hóa học của diêm tiêu Chile là:
A. Ca(NO 3 ) 2 B. NH 4 NO 3 C. NH 4 Cl D. NaNO 3
Câu 10: Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
A. NO B. N 2 O C. NH 3 D. NO 2
Câu 11: Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen B. Ammonnia C. Oxygen D. Hydrogen
Câu 12: Cho các nhận định sau: Phân tử ammonia và ion ammonium đều
(1) chứa liên kết cộng hóa trị
(2) là base Bronsted trong nước
(3) là acid Bronsted trong nước
(4) chứa nguyên tử N có số oxi hóa là -3
Số nhận định đúng là:
A. 2 B. 1 C. 4 D. 3
Câu 13: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH 3 thoát ra.
Câu 14: Mưa acid là hiện tượng nước mưa có PH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hòa trong nước). Hai tác nhân chính gây mưa acid là
A. Cl 2 , HCl B. N 2 , NH 3 C. SO 2 , NO x D. S, H 2 S
Câu 1 5 : Cho phản ứng sau: \(Al + HN{O_3} \to Al{(N{O_3})_{_3}} + {N_2}O + {H_2}O\)
Hệ số phản ứng của các chất lần lượt là:
A. 3, 15, 3, 1, 7
B. 8, 30, 8, 3, 15
C. 3, 30, 3, 8, 15
D. 8, 15, 8, 3, 15
II. Tự luận (4 điểm)
Câu 1 (2 điểm): Trong công nghiệp, hydrogen được sản xuất từ phản ứng:
\(C{H_4}(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3{H_2}(g) + CO(g)\)
(a) Tính hằng số cân bằng K C của phản ứng trên ở 760 o C. Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH 4 , H 2 O và CO ở trạng thái cân bằng lần lượt là 0,126M; 1,150M và 0,126M
(b) Ở 760 o C, giả sử ban đầu chỉ có CH 4 và H 2 O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H 2 ở trạng thái cân bằng là 0,6M
Câu 2 (2 điểm) Trộn 100ml dung dịch có pH =1 gồm HCl và HNO 3 với 100ml dung dịch NaOH nồng độ a (M) thu được 200ml dung dịch có pH = 12. Tính giá trị của a(M)
---Hết---
Đề 3
I. Trắc nghiệm (6 điểm)
Câu 1: Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi:
A. Tốc độ phản ứng thuận bằng hai lần tốc độ phản ứng nghịch
B. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch
C. Tốc độ phản ứng thuận bằng một nửa tốc độ phản ứng nghịch
D. Tốc độ phản ứng thuận bằng k lần tốc độ phản ứng nghịch
Câu 2: Cân bằng hóa học là cân bằng
A.. Động
B. Tĩnh
C. Ổn định
D. Đều
Câu 3: Xét cân bằng: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\)
Biểu thức hằng số cân bằng của phản ứng là:
A. \({K_C} = \frac{{{\rm{[}}N{H_3}]}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}}\)
B. \({K_C} = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^2}}}\)
C. \({K_C} = \frac{{{\rm{[}}{N_2}]{\rm{[}}{H_2}]}}{{{\rm{[}}N{H_3}]}}\)
D. \({K_C} = \frac{{{\rm{[}}{N_2}]{{{\rm{[}}{H_2}]}^2}}}{{{{{\rm{[}}N{H_3}]}^2}}}\)
Câu 4: Ở nhiệt độ nhất định, phản ứng thuận nghịch: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) đạt trạng thái cân bằng khi nồng độ của các chất như sau: [H 2 ] = 2M; [N 2 ] = 0,01M; [NH 3 ] = 0,4M. Hằng số cân bằng ở nhiệt độ có giá trị là?
A. 2 B. 3 C. 5 D. 7
Câu 5: Cho phương trình: \({S^{2 - }} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - } + O{H^ - }\). Phát biểu nào sau đây là đúng?
A. H 2 O là base B. S 2- là base
C. HS - là base D. S 2- là acid
Câu 6: Dung dịch NaOH 0,01M có giá trị pH là
A. 2 B. 1 C. 13 D. 12
Câu 7: Chuẩn độ 20ml dung dịch HCl chưa biết nồng độ đã dùng hết 17ml dung dịch NaOH 0,12M. Nồng độ mol của dung dịch HCl là:
A. 0,2M B. 0,102M C. 0,1M D. 0,21M
Câu 8: Cấu hình electron nguyên tử của nitrogen là
A. 1s 2 2s 2 2p 1 . B. 1s 2 2s 2 2p 5 .
C. 1s 2 2s 2 2p 4 . D. 1s 2 2s 2 2p 3 .
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại trong hợp chất hữu cơ nào sau đây?
A. Tinh bột B. Cellulose C. Protein D. Glucose
Câu 10: Khí nào sau đây dễ tan trong nước do tạo được liên kết kydrogen với nước:
A. Nitrogen B. Hydrogen C. Ammnonia D. Oxygen
Câu 11: Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
A. Hồng B. Xanh C. Không màu D. Vàng
Câu 12: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH 3 có lẫn hơi nước, có thể dẫn khí NH 3 đi qua bình đựng dung dịch H 2 SO 4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH 3 , quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 1. D. 4.
Câu 13: Xét phản ứng trong quá trình tạo ra NOx nhiệt:
\({N_2}(g) + {O_2}(g) \to 2NO(g)\) \({\Delta _r}H_{298}^o = 180,6kJ\)
Nhiệt tạo thành chuẩn của NO(g) là
A. 180,6 kJ/mol B. -180,6 kJ/mol
C. -90,3 kJ/mol D. 90,3 kJ/mol
Câu 14: Phát biểu nào sau đây là không đúng khi nói về ammnonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Câu 15: Cho 100 ml dung dịch NH 4 Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH 3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
II. Tự luận (4 điểm)
Câu 1 (2 điểm): Ethanol và propanoic acid phản ứng với nhau tạo thành ethy propanoate theo phản ứng hóa học sau: \({C_2}{H_5}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {C_2}{H_5}COO{C_2}{H_5}(l) + {H_2}O(l)\)
Ở 50 0 C, giá trị K C của phản ứng trên là 7,5. Nếu cho 23,0 g ethanol phản ứng với 37,0 g propanoic acid ở 50 0 C thì khối lượng của ethy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Câu 2 (2 điểm): Trộn lẫn 3 dung dịch H 2 SO 4 0,1M, HNO 3 0,2M và HCl 0,3M với những thể tích bằng nhau, thu được dung dịch X. Lấy 300ml dung dịch X cho phản ứng với V lít dung dịch Y gồm NaOH 0,2M và KOH 0,29M thu được dung dịch Z có pH = 2. Tính giá trị của V.
---Hết---
Đề 4
I. Trắc nghiệm (6 điểm)
Câu 1: Phản ứng thuận nghịch là phản ứng
A. phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện
B. có phương trình hóa học được biểu diễn bằng mũi tên một chiều
C. chỉ xảy ra theo một chiều nhất định
D. xảy ra giữa hai chất khí
Câu 2: Phản ứng nào sau đây là phản ứng thuận nghịch?
A. \(Mg + 2HCl \to MgC{l_2} + {H_2}\)
B. \(2S{O_2} + {O_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}\)
C. \({C_2}{H_5}OH + 3{O_2} \to 2C{O_2} + 3{H_2}O\)
D. \(KCl{O_3} \to 2KCl + 3{O_2}\)
Câu 3: Biểu thức nào sau đây là biểu thức hằng số cân bằng K C của phản ứng:
\(C(s) + 2{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{H_4}(g)\)
A. \({K_C} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}{H_2}]}}\)
B. \({K_C} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}C{\rm{][}}{H_2}{]^2}}}\)
C. \({K_C} = \frac{{{\rm{[}}C{H_4}]}}{{{\rm{[}}C{\rm{][}}{H_2}]}}\)
D. \({K_C} = \frac{{{\rm{[}}C{H_4}]}}{{{{{\rm{[}}{H_2}]}^2}}}\)
Câu 4: Cho cân bằng:
\(\begin{array}{l}(1){H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\\(2)2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{O_2}(g)\\(3)CO(g) + C{l_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} COC{l_2}(g)\\(4)CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(g)\\(5)3Fe(s) + 4{H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} F{e_3}{O_4}(s) + 4{H_2}(g)\end{array}\)
Các cân bằng chuyển dịch theo chiều thuận khi tăng áp suất là
A. (1), (4)
B. (1), (5)
C. (2), (3), (5)
D. (2), (3)
Câu 5: Chất nào sau đây là chất điện li mạnh?
A. H 2 O B. CH 3 COOH C. HNO 3 D. CH 3 OH
Câu 6: Hằng số cân bằng K C của phản ứng: \({H_2}(g) + B{r_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HBr(g)\) ở 730 o C là 2,18.10 6 . Cho 3,2 mol HBr vào trong bình phản ứng dung dịch 12 lít ở 730 o C. Tính nồng độ của H 2 ở trạng thái cân bằng?
A. 2,7.10 -4 B. 1,82.10 -4 C. 1,57.10 -4 D. 3,2.10 -4
Câu 7: Chất nào sau đây không phải chất điện li?
A. CH 3 COOH B. C 2 H 5 OH C. H 2 O D. CuSO 4
Câu 8: Một dung dịch có nồng độ [OH - ]= 2,5.10 -10 M. Môi trường của dung dịch thu được có tính chất
A. Base B. Acid
C. Trung tính D. Lưỡng tính
Câu 9: Chuẩn độ 10ml dung dịch H 2 SO 4 chưa biết nồng độ đã dùng hết 20ml dung dịch KOH 0,1M. Nồng độ mol của dung dịch H 2 SO 4 là:
A. A. 0,2M B. 0,05M C. 0,1M D. 0,15M
Câu 10: Tính chất nào sau đây của nitrogen không đúng ?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.
Câu 11: Trong các hợp chất, nitrogen thể hiện các số oxi hóa:
A. +1, +2, +3, +4, -4
B. 1, 2, 3, 4, 5, 6
C. -3, +1, +2, +3, +4, +5
D. +2, -2, +4, +6
Câu 12: Bậc liên kết và năng lượng liên kết trong phân tử nitrogen tương ứng là:
A. 2 và 418 kJ/mol B. 1 và 167 kJ/mol
C. 1 và 386 kJ/mol D. 3 và 945 kJ/mol
Câu 13: Nhận định nào sau đây về phân tử ammonia không đúng?
A. Phân cực mạnh
B. Có một cặp electron không liên kết
C. Có độ bền nhiệt rất cao
D. Có khả năng nhận proton
Câu 14: Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
A. NH 3 B. NH 4 + C. NO 3 - D. N 2
Câu 15: Tã lót trẻ em sau khi được giặt sạch vẫn còn mùi khai do vẫn lưu lại một lượng ammonia. Để khử hoàn toàn mùi của ammonia thì người ta cho vào nước xả cuối cùng một ít hoá chất có sẵn trong nhà. Hãy chọn hóa chất thích hợp:
A. Phèn chua. B. Giấm ăn.
C. Muối ăn. D. Nước gừng tươi.
II. Tự luận (4 điểm)
Câu 1: Cho cân bằng hóa học sau: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\) \({\Delta _r}H_{298}^o = 92kJ\)
Cho 3,0 mol khí hydrogen và 1,0 mol khí nitrogen vào một bình kín dung dịch 10 lít, có bột iron xúc tác, giữ bình ở 450 o C. Ở trạng thái cân bằng có 20% chất đầu chuyển hóa thành sản phẩm
(a) Xác định số mol các chất ở trạng thái cân bằng
(b) Tính hằng số cân bằng của phản ứng ở nhiệt độ trên
(c) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nào?
Câu 2:
a) Cho a lít dung dịch KOH có pH = 12,0 vào 8,00 lít dung dịch HCl có pH = 3,0 thu được dung dịch Y có pH = 11,0. Tính giá trị của a (lít)
b) Để xác định nồng độ của dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,02 M. Để chuẩn độ 5ml dung dịch HCl này cần 10ml dung dịch NaOH. Tính nồng độ của dung dịch HCl.
Đề 5
I. Trắc nghiệm (6 điểm)
Câu 1: Phản ứng thuận nghịch là:
A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
B. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
C. Phản ứng trong đó ở cùng điều kiện, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
D. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Câu 2: Dãy chất nào sau đây chỉ gồm những chất tan và điện li mạnh?
A. HNO 3 , Cu(NO 3 ) 2 , Ca 3 (PO 4 ) 2 , H 3 PO 4
B. H 2 SO 4 , NaCl, KNO 3 , Ba(NO 3 ) 2
C. CaCl 2 , CuSO 4 , CaSO 4 , HNO 3
D. KCl, H 2 SO 4 , H 2 O, CaCl 2
Câu 3 : Theo thuyết Bronsted – Lowry về acid – base, những chất có khả năng cho H + là
A. acid B. base C. lưỡng tính D. muối
Câu 4: Trong các phản ứng dưới đây, ở phản ứng nào nước đóng vai trò là base?
A. \(HCl + {H_2}O \to {H_3}{O^ + }\)
B. \(Ca{(HC{O_3})_{_2}} \to CaC{O_3} + {H_2}O + C{O_2}\)
C. \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
D. \(CuS{O_4} + 5{H_2}O \to CuS{O_4}.5{H_2}O\)
Câu 5: Trộn lẫn 50ml dung dịch Ba(OH) 2 0,05M với 150ml dung dịch HCl 0,02M thu được dung dịch có pH là:
A. 1 B. 12 C. 13 D. 2
Câu 6: Nitrogen trong không khí có vai trò nào sau đây?
A. Cung cấp đạm tự nhiên cho cây trồng.
B. Hình thành sấm sét.
C. Tham gia quá trình quang hợp của cây.
D. Tham gia hình thành mây.
Câu 7: Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là:
A. chất khử B. chất oxi hóa C. acid D. base
Câu 8: Trong công nghiệp, ammonia được sản xuất theo phản ứng pha khí:
\({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\)
Cho biết các giá trị năng lượng liên kết E b (Kj.mol -1 ):
|
Liên kết |
N\( \equiv \)N |
H-H |
N-H |
|
E b |
945 |
436 |
386 |
Nhiệt của phản ứng trên là:
A. 1481 kJ B. – 1481 kJ C. 78 kJ D. -78kJ
Câu 9: Xét cân bằng tạo ra nitrogen(II) oxide ở nhiệt độ 2000 o C:
\({N_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2NO(g)\) K C = 4,10.10 -4
Ở trạng thái cân bằng, biểu thức nào sau đây có giá trị bằng K C ?
A. \(\frac{{{{{\rm{[}}NO]}^2}}}{{{\rm{[}}{N_2}]{\rm{[}}{O_2}]}}\) B. \(\frac{{{\rm{[}}NO]}}{{{\rm{[}}{N_2}]{\rm{[}}{O_2}]}}\) C.\(\frac{{{\rm{[}}{N_2}]{\rm{[}}{O_2}]}}{{{{{\rm{[}}NO]}^2}}}\) D. \(\frac{{{\rm{[}}NO]}}{{{\rm{[}}{N_2}]}}\)
Câu 10: Xét các phản ứng tạo thành oxide của nitrogen:
(1) \({N_2}(g) + {O_2}(g) \to 2NO(g)\) \({\Delta _r}H_{298}^o = 180,6kJ\)
(2) \(2NO(g) + {O_2}(g) \to 2N{O_2}(g)\) \({\Delta _r}H_{298}^o = - 114,2kJ\)
(3) \({N_2}(g) + 2{O_2}(g) \to 2N{O_2}(g)\)
\({\Delta _r}H_{298}^o\) của phản ứng (3) là:
A. -292 kJ B. 66,2 kJ C. 247 kJ D. 33,2 kJ
Câu 11: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH 4 + , NH 3 .
B. NH 4 + , NH 3 , H + .
C. NH 4 + , OH - .
D. NH 4 + , NH 3 , OH -
Câu 12: Khí cười (laughing gas) thực chất là một chất kích thích được bán tại các quán bar ở một số quốc gia. Người ta bơm khí này vào một trái bóng bay, gọi là bóng cười và cung cấp cho các khách có yêu cầu. Giới Y khoa thế giới đã cảnh báo rằng khí cười ảnh hưởng trực tiếp tới hệ tim mạch, hệ thần kinh mà hậu quả xấu nếu là lạm dụng sẽ dẫn tới trầm cảm hoặc thiệt mạng. Khí cười có công thức là
A. NO 2 . B. CO. C. NO. D. N 2 O.
Câu 13: Để xác định nồng độ của một dung dịch HNO 3 , người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,01M. Để chuẩn độ 10ml dung dịch HNO 3 này cần 20ml dung dịch NaOH. Xác định nồng độ của dung dịch HNO 3 .
A. 0,05M B. 0,1M C. 0,04M D. 0,02M
Câu 14: Hòa tan m gam FeO bằng dung dịch HNO 3 dư thu được 6,1975 lít hỗn hợp khí X gồm NO, N 2 O (đkc) (biết tỉ khối X so với H 2 bằng 19,2). Giá trị m là
A. 72. B. 86,4. C. 108. D. 144.
Câu 15: Cho phản ứng: \(CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(g)\) \({\Delta _r}H_{298}^0 > 0\)
Cân bằng phản ứng trên dịch chuyển theo chiều thuận khi
A. Giảm nhiệt độ
B. Tăng áp suất
C. Giảm nồng độ CO 2
D. Thêm chất xúc tác
II. Tự luận (4 điểm)
Câu 1 (2 điểm): Trộn 100ml dung dịch có pH =1 gồm HCl và HNO 3 với 100ml dung dịch NaOH nồng độ a (M) thu được 200ml dung dịch có pH = 12. Tính giá trị của a(M)
Câu 2 (2 điểm): Cho 5,6 gam CO và 5,4 gam H 2 O vào một bình kiến dung dịch không đổi 10 lít. Nung nóng bình một thời gian ở 830 o C để hệ đạt đến trạng thái cân bằng:
\(CO(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{O_2}(g) + {H_2}(g)\)(hằng số cân bằng K C = 1). Tính nồng độ cân bằng của CO, H 2 O.
---Hết---
Đề 6
Câu 1: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
A. N 2 O. B. NO 2 . C. N 2 O 5 D. NO.
Câu 2: X là chất khí không màu, mùi khai và gây xốc nếu hít phái, là nguyên liệu để sản xuất một loại phân bón. Khí X là
A. N 2 . B. NO 2 . C. NO. D. NH 3 .
Câu 3: Cho cấu trúc của NH 3 như hình bên.
Nhận định nào dưới đây đúng về NH 3 .
A. Nguyên tử nitrogen còn 1 electron chưa tham gia liên kết.
B. Liên kết giữa nguyên tử nitrogen và nguyên tử hydrogen là liên kết cho nhận.
C. Hình học phân tử của NH 3 là hình chóp tam giác, với nguyên tử nitrogen nằm ở tâm hình chóp.
D. Nguyên tử nitrogen có khả năng tạo thêm liên kết với 1 nguyên tử hydrogen để tạo anion.
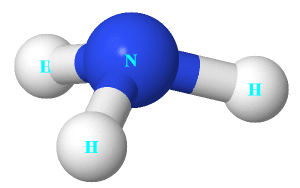
Câu 4: Tính base của NH 3 do
A. trên nguyên tử nitrogen còn cặp electron chưa tham gia liên kết.
B. trong phân tử có 3 liên kết cộng hóa trị phân cực.
C. phân tử ammonia tan nhiều trong nước.
D. ammonia là chất khí ở điều kiện thường.
Câu 5: Cho 3,7185 lít N 2 tác dụng với 6,1975 lít H 2 thu được 7,437 lít hỗn hợp khí. Biết thể tích các khí đo ở điều kiện chuẩn. Hiệu suất của phản ứng là
A. 30%. B. 40%. C. 50%. D. 60%.
Câu 6: Số oxi hóa cao nhất của sulfur trong hợp chất là
A. +2. B. +3. C. +4. D. +6.
Câu 7: Phát biểu nào sau đây sai ?
A. SO 2 dùng làm chất tẩy trắng giấy và bột giấy.
B. SO 2 dùng làm chất chống mốc lương thực , thực phẩm.
C. Trong phòng thí nghiệm, SO 2 được điều chế bằng cách đốt quặng pyrite.
D. SO 2 là chất trung gian để sản xuất sulfuric acid.
Câu 8: Nung nóng hỗn hợp gồm 3,6 gam Mg và 3,83 gam S trong điều kiện không có không khí, thu được chất rắn X. Cho chất rắn X tác dụng với dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Tỉ khối của Y so với khí hydrogen là
A. 16,2. B. 15,8. C. 11,2. D. 13,8.
Câu 9: Để giảm mưa acid cũng như các tác hại do mưa acid gây ra, các biên pháp có thể thực hiện là
(a) Tăng cường sử dụng các nhiên liệu hóa thạch.
(b) Xử lí nước thải trước khi đưa vào môi trường.
(c) Khử sulfur có trong nhiên liệu hóa thạch.
(d) Phát triển các nguồn năng lượng xanh.
(đ) Bón vôi vào đất bị acid hóa.
Số biện pháp đúng là
A. 4. B. 2. C. 3. D. 5.
Câu 10: Dung dịch H 2 SO 4 (đặc) gây bỏng da khi tiếp xúc do
A. tính hóa nước của H 2 SO 4 (đặc), quá trình này tỏa nhiệt và sự oxi hóa tế bào.
B. dung dịch H 2 SO 4 (đặc) phản ứng với các hợp chất hữu cơ.
C. do tính acid của H 2 SO 4 .
D. do tính oxi hóa mạnh của H 2 SO 4 đặc.
Câu 11: Điều nào sau đây đúng với phản ứng hóa học ở trạng thái cân bằng?
A. Chỉ có phản ứng thuận dừng lại. B. Chỉ có phản ứng nghịch dừng lại.
C. Cả phản ứng thuận và nghịch dừng lại. D. Tốc độ của phản ứng thuận và nghịch bằng nhau.
Câu 12: Xét cân bằng sau:
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g)
Nếu tăng nồng độ SO 2 (g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào lượng SO 2 thêm vào.
D. Không thay đổi.
Câu 13: Xét cân bằng hóa học: CH 3 COOH(l) + C 2 H 5 OH(l) ⇌ CH 3 COOC 2 H 5 (l) + H 2 O(l)
Trong bình có thể tích 500 mL hỗn hợp phản ứng ở trạng thái cân bằng chứa 0,235 mol CH 3 COOH, 0,0350 mol C 2 H 5 OH; 0,182 mol CH 3 COOC 2 H 5 và 0,182 mol nước. Giá trị hằng số cân bằng K C của cân bằng trên là
A. 0,248. B. 4,027. C. 0,496. D. 2,105.
Câu 14: Xét hai cân bằng liên quan đến SO 2 (g) và các hằng số cân bằng tương ứng:
SO 2 (g) + 1/2O 2 (g) ⇌ SO 3 (g) K c1 (1)
2SO 3 (g) ⇌ 2SO 2 (g) + O 2 (g) K c2 (2)
Mối quan hệ giữa \({K_{{c_1}}}\)và \({K_{{c_2}}}\)là
A. \({K_{{c_2}}} = K_{{c_1}}^2\) . B. \(K_{{c_2}}^2 = {K_{{c_1}}}\). C. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^2}}\) . D. \({K_{{c_2}}} = \frac{1}{{K_{{c_1}}^{}}}\).
Câu 15: Cho các cân bằng sau trong bình kín (giữ nguyên nhiệt độ):
(I) 2HI(g) ⇌ H 2 (g)+ I 2 (g)
(II) N 2 (g)+ 3H 2 (g) ⇌ 2NH 3 (g)
(III) PCl 5 (g) ⇌ PCl 3 (g)+ Cl 2 (g)
(IV) CaCO 3 (s) ⇌ CaO(s)+ CO 2 (g)
(V) SO 2 Cl 2 (g) ⇌ SO 2 (g)+ Cl 2 (g)
(VI) N 2 O 4 (g) ⇌ 2NO 2 (g)
Khi tăng áp suất của hệ thì số cân bằng bị chuyển dịch theo chiều nghịch là
A. 2. B. 3. C. 4. D. 5.
Câu 16: Phosphorus(V) chloride bị phân hủy ở nhiệt độ cao thành phosphorus (III) chloride và chlorine theo phương trình: PCl 5 (g) ⇌ PCl 3 (g) + Cl 2 (g)

A. Đồ thị A. B. Đồ thị B. C. Đồ thị C. D. Đồ thị D.
Câu 17: Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu. B. anion (ion âm). C. cation (ion dương). D. chất.
Câu 18: Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO 3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm khử duy nhất). Kim loại M là
A. Cu. B. Zn. C. Mg. D. Fe.
Câu 19: Phương trình điện li viết đúng là
A. NaCl ⟶ Na 2+ + Cl 2- . B. Ca(OH) 2 ⟶ Ca 2+ + 2OH - .
C. C 2 H 5 OH ⟶ C 2 H 5 + + OH - . D. CH 3 COOH ⟶ CH 3 COO - + H + .
Câu 20: Hỗn hợp X gồm N 2 và H 2 có tỉ khối so với He bằng 1,75. Cho 19,3362 lít hỗn hợp X qua xúc tác thích hợp, nung nóng, sau một thời gian thu được 17,47695 lít hỗn hợp khí Y. Biết thể tích khí đo ở đkc. Hiệu suất phản ứng tổng hợp ammonia là
A. 22%. B. 25%. C. 30%. D. 32%.
----- HẾT -----
Đề 7
Câu 1: Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là sai ?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Câu 2: Cho 0,4 mol SO 2 và 0,6 mol O 2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO 3 trong bình là 0,3 mol. Giá trị hằng số cân bằng K C của phản ứng ở nhiệt độ trên là
A. 6,67. B. 20. C. 0,05. D. 10.
Câu 3: Nhũ đá được hình thành trong các hang động liên quan đến cân bằng sau:
Ca(HCO 3 ) 2 (aq) ⇌ CaCO 3 (s) + CO 2 (aq) + H 2 O(l)
Nếu nồng độ CO 2 hòa tan trong nước tăng lên thì
A. quá trình hình thành nhũ đá được diễn ra thuận lợi.
B. quá trình theo chiều nghịch diễn ra thuận lợi.
C. cân bằng chuyển dịch theo chiều thuận nhằm làm tăng nồng độ CO 2 .
D. cân bằng chuyển dịch theo chiều thuận nhằm làm giảm nồng độ CO 2 .
Câu 4: Đâu là nhận định sai về hằng số cân bằng?
A. Hằng số cân bằng K C phụ thuộc vào bản chất của phản ứng, nhiệt độ và áp suất.
B. K C có giá trị càng lớn thì phản ứng thuận càng chiếm ưu thế.
C. K C có giá trị càng nhỏ thì phản ứng thuận càng hạn chế.
D. K C tỉ lệ thuận với tích nồng độ chất sản phẩm với số mũ tương ứng.
Câu 5: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy pH đo được giá trị pH là 4,5. Có một số kết luận sau:
(a) Môi trường cúa dung dịch là trung tính.
(b) Loại đất trên là đất chua.
(c) Để giảm độ chua cho đất, người ta có thể cho thêm vôi bột vào đất.
(d) Có thể trồng một số loại cây ưa trồng trong đất chua như: húng quế, bắp cải,…
Số kết luận đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 6: Cho cân bằng hóa học sau:
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g) ∆ r H 0 298 < 0
Cho các biện pháp:
(a) tăng nhiệt độ.
(b) tăng áp suất chung của hệ phản ứng.
(c) dùng thêm chất xúc tác V 2 O 5 .
(d) giảm nồng độ SO 3 .
Có bao nhiêu biện pháp làm cân bằng chyển dịch theo chiều thuận?
A. 3. B. 2. C. 1. D. 4.
Câu 7: Cho 11,2 gam khí nitrogen tác dụng với 0,8 gam hydrogen. Sau phản ứng đạt trạng thái cân bằng thu được 2,55 gam ammonia. Giá trị của hằng số cân bằng của phản ứng gần nhất với giá trị nào sau đây?
A. 1. B. 3. C. 13. D. 12.
Câu 8: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H + ] của nước chanh là 10 -2,4 mol/L.
C. Nồng độ ion [H + ] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH - ] của nước chanh nhỏ hơn 10 -7 mol/L.
Câu 9: Cho các nhận định sau:
(a) Nguyên tắc chuẩn độ acid – base: sử dụng dung dịch acid hoặc dung dịch base đã biết chính xác nồng độ để xác định nồng độ dung dịch acid hoặc dung dịch base cần chuẩn độ.
(b) Thời điểm gây ra sự chuyển màu của chị thị acid – base là điểm tương đương.
(c) Có thể chọn bất kì chỉ thị acid – base nào quá trình chuẩn độ acid – base.
(d) Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác.
(đ) Trong quá trình chuẩn độ, giữ nguyên bình tam giác.
Số nhận định đúng là:
A. 4. B. 3. C. 2. D. 1.
Câu 10: Trộn 300 mL dung dịch có pH = 2 gồm HCl và HNO 3 vào 200 mL dung dịch NaOH nồng độ a (M) thu được 500 mL dung dịch có pH = 11. Giá trị của a gần nhất với
A. 0,01. B. 0,02. C. 0,03. D. 0,04.
Câu 11: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
A. 5. B. 4. C. 9. D. 10.
Câu 12: Trộn lẫn V mL dung dịch NaOH 0,01 M với V mL dung dịch HCl 0,03 M được 2V mL dung dịch Y. Dung dịch Y có giá trị pH là
A. 4. B. 3. C. 2. D. 1.
Câu 13: Tiến hành chuẩn độ acid – base mạnh bằng 10 mL HCl 0,1 M. Khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL. Nồng độ của dung dịch NaOH nhận giá trị là
A. 0,097 M. B. 0,1027 M. C. 0,001 M. D. 0,184 M.
Câu 14: Trộn 200 mL dung dịch gồm HCl 0,1M và H 2 SO 4 0,05M vào 300 mL dung dịch Ba(OH) 2 có nồng độ a mol/L thu được có pH = 13. Giá trị của a là
A. 0,15. B. 0,2. C. 0,1. D. 0,25.
Câu 15: X là chất khí không màu ở điều kiện thường, X chiếm phần trăm về thể tích lớn nhất trong không khí. Ở điều kiện thường X khá trơ hóa học. Tuy nhiên ở nhiệt độ cao, X hoạt động tương đối mạnh. Vậy khí X là
A. O 2 . B. CO 2 . C. H 2 . D. N 2 .
Câu 16: NH 3 thể hiện tính khử khi tác dụng với chất nào sau đây?
A. O 2 . B. HCl. C. H 2 O. D. H 2 SO 4 .
Câu 17: Cho 7,437 lít khí N 2 tác dụng với 14,874 lít khí H 2 với điều kiện thích hợp thu được V lít hỗn hợp khí (biết H% = 20%). Biết các khí được đo ở điều kiện chuẩn. Giá trị V là
A. 13,440. B. 14,560. C. 16,576. D. 20,3278.
Câu 18: Acid HNO 3 đặc nóng phản ứng được với nhóm chất nào sau đây?
A. C, Fe 2 O 3 , Fe 3 O 4 , H 2 SO 4 . B. CuO, NH 3 , Ag, Pt.
C. CuO, NH 3 , Fe 2 O 3 , Cu, FeCl 2 . D. CuO, NH 3 , FeSO 4 , CO 2 , Au.
Câu 19: Cho 1,35g hỗn hợp Cu, Mg, Al tác dụng hết với dung dịch HNO 3 thu được hỗn hợp khí gồm 0,01 mol NO và 0,04 mol NO 2 và phản ứng không tạo muối ammonium. Khối lượng muối tạo ra trong dung dịch là
A. 5,69 g. B. 3,79 g. C. 8,53 g. D. 9,48 g.
Câu 20: Dung dịch X có 0,1 mol K + ; 0,2 mol Mg 2+ ; 0,1 mol Na + ; 0,2 mol Cl - và a mol Y - . Cô cạn dung dịch X thu được m gam muối khan. Ion Y - và giá trị của m là
A. OH - và 30,3. B. NO 3 - và 23,1. C. NO 3 - và 42,9. D. OH - và 20,3.
----- HẾT -----