Bài 19. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 110, 111, 112 Hóa 12 Chân trời sáng tạo
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất bao gồm các nguyên tố từ Sc
CH tr 110 MĐ
Trả lời câu hỏi Mở đầu trang 110 SGK Hóa 12 Chân trời sáng tạo
Trong bảng tuần hoàn các nguyên tố hoá học, kim loại chuyển tiếp dãy thứ nhất bao gồm các nguyên tố từ Sc đến Cu. Cấu hình electron của nguyên tử các nguyên tố này có đặc điểm gì? Chúng có những tính chất vật lí và ứng dụng nào?
Phương pháp giải:
Nêu đặc điểm cấu hình electron, tính chất vật lí và ứng dụng của các kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
- Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d 1÷10 4s 1÷2 .
- Tính chất vật lí: Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại nhóm IA và nhóm IIA trong cùng chu kì.
- Ứng dụng:
+ Đồng được dùng trong sản xuất các thiết bị như: biến thế, cầu dao điện, dây dẫn điện,...
+ Chromium được dùng mạ lên các thiết bị để chống mài mòn, chế tạo hợp kim đặc biệt.
+ Scandium, titanium được dùng để chế tạo hợp kim ứng dụng trong hàng không, vũ trụ.
+ Vanadium được dùng trong chế tạo thiết bị chịu nhiệt.
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
+ Nickel được dùng để chế tạo các hợp kim sử dụng trong máy móc, thiết bị.
CH tr 110 TL
Trả lời câu hỏi Thảo luận trang 110 SGK Hóa 12 Chân trời sáng tạo
Quan sát Bảng 19.1, hãy cho biết đặc điểm cấu hình electron của các nguyên tử kim loại chuyển tiếp dãy thứ nhất.
Phương pháp giải:
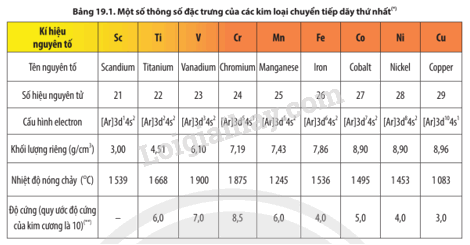
Lời giải chi tiết:
Cấu hình electron nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có dạng [Ar]3d 1÷10 4s 1÷2 . Nguyên tử của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có electron hoá trị nằm ở phân lớp 3d và 4s.
CH tr 111
Trả lời câu hỏi Thảo luận trang 111 SGK Hóa 12 Chân trời sáng tạo
Dựa vào số liệu trong Bảng 19.1, Bảng 17.2 và Bảng 18.2, hãy nhận xét, so sánh nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca. Cho biết độ cứng của Ca là 1,75.
Phương pháp giải:
Quan sát số liệu các Bảng 19.1, Bảng 17.2 và Bảng 18.2 để nhận xét và so sánh.
Lời giải chi tiết:
- Các kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, khối lượng riêng, độ cứng cao hơn kim loại K và Ca.
- Thứ tự tăng dần về nhiệt độ nóng chảy, khối lượng riêng, độ cứng của các kim loại chuyển tiếp dãy thứ nhất với kim loại K và Ca là K; Ca; kim loại chuyển tiếp dãy thứ nhất.
CH tr 112 LT1
Trả lời câu hỏi Luyện tập 1 trang 112 SGK Hóa 12 Chân trời sáng tạo
Lấy một số ví dụ về ứng dụng của sắt trong thực tế.
Phương pháp giải:
Liên hệ thực tế và tham khảo thông tin ở mục 2, trang 112, sách giáo khoa.
Lời giải chi tiết:
- Sắt được sử dụng để sản xuất gang, thép và các hợp kim khác của sắt.
- Hợp chất của sắt được sử dụng để làm chất diệt sâu bọ, pha chế sơn mực, làm chất xúc tác cho phản ứng hữu cơ, làm sơn chổng gỉ,…
- Các hợp kim của sắt có nhiều ứng dụng khác nhau như
+ Sắt, manganese được dùng trong sản xuất thiết bị quốc phòng, công nghiệp, nông nghiệp, đời sống.
+ Sắt, cobalt được dùng để chế tạo nam châm điện.
CH tr 112 LT2
Trả lời câu hỏi Luyện tập 2 trang 112 SGK Hóa 12 Chân trời sáng tạo
Hãy viết cấu hình electron của các ion: Cu 2+ , Fe 3+ , Cr 3+ , Mn 2+ .
Phương pháp giải:
Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…
Lời giải chi tiết:
Cu 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9
Fe 3+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Cr 3+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3
Mn 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
CH tr 112 TL1
Trả lời câu hỏi Thảo luận trang 112 SGK Hóa 12 Chân trời sáng tạo
Quan sát Hình 19.1, hãy nhận xét về màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất.
Phương pháp giải:

Lời giải chi tiết:
Trong dung dịch, ion của kim loại chuyển tiếp dãy thứ nhất thường có màu.
CH tr 113 TL1
Trả lời câu hỏi Thảo luận 1 trang 113 SGK Hóa 12 Chân trời sáng tạo
Dự đoán hiện tượng xảy ra trong thí nghiệm xác định hàm lượng muối Fe(ll) bằng dung dịch thuốc tím.
Phương pháp giải:
Dung dịch FeSO 4 trong môi trường acid làm mất màu dung dịch KMnO 4 .
\(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Lời giải chi tiết:
Hiện tượng: Khi nhỏ thuốc tím vào dung dịch muối Fe(II), màu hồng của thuốc tím biến mất. Sau khi kết thúc chuẩn độ, dung dịch xuất hiện màu hồng.
CH tr 113 TL2
Trả lời câu hỏi Thảo luận 2 trang 113 SGK Hóa 12 Chân trời sáng tạo
Từ kết quả chuẩn độ, xác định nồng độ Fe 2+ trong dung dịch đã pha.
Phương pháp giải:
Học sinh dựa vào kết quả thực tế để tính nồng độ Fe 2+ .
Lời giải chi tiết:
Giả sử thể tích dung dịch KMnO 4 trong thí nghiệm đã dùng là V (L).
Þ \({{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,02{\rm{V (mol)}}\)
Theo phương trình hóa học: \({{\rm{n}}_{{\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}}}{\rm{ = 5}}{{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,1{\rm{V (mol)}}\)
\( \Rightarrow {{\rm{C}}_M}{\rm{(F}}{{\rm{e}}^{2 + }}{\rm{) = }}\frac{{0,1{\rm{V}}}}{{0,01}}{\rm{ (M)}}\)
CH tr 114 TL
Trả lời câu hỏi Thảo luận trang 114 SGK Hóa 12 Chân trời sáng tạo
Nêu hiện tượng quan sát được trong thí nghiệm nhận biết các ion Cu 2+ và Fe 3+ , viết phương trình hoá học của phản ứng xảy ra và giải thích.
Phương pháp giải:
Thuốc thử để nhận biết các ion Cu 2+ và Fe 3+ là ion \({\rm{O}}{{\rm{H}}^ - }\).
Lời giải chi tiết:
- Khi nhỏ dung dịch NaOH vào dung dịch CuSO 4 , xuất hiện kết tủa màu xanh lam.
Phương trình hóa học: \(2{\rm{NaOH }} + {\rm{ CuS}}{{\rm{O}}_{\rm{4}}} \to {\rm{N}}{{\rm{a}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} + {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow \)
Kết tủa màu xanh lam là Cu(OH) 2 .
- Khi nhỏ dung dịch NaOH vào dung dịch FeCl 3 , xuất hiện kết tủa màu nâu đỏ.
Phương trình hóa học: \(3{\rm{NaOH }} + {\rm{ FeC}}{{\rm{l}}_{\rm{3}}} \to 3{\rm{NaCl}} + {\rm{Fe(OH}}{{\rm{)}}_3} \downarrow \)
Kết tủa màu xanh lam là Fe(OH) 3 .
CH tr 114 BT1
Trả lời câu hỏi Bài tập 1 trang 114 SGK Hóa 12 Chân trời sáng tạo
Viết cấu hình electron của các ion: Cr 2+ , Fe 2+ , Ni 2+ , Co 2+ , Co 3+ .
Phương pháp giải:
Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các electron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…
Lời giải chi tiết:
Cr 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4
Fe 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6
Ni 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8
Co 2+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7
Co 3+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6
CH tr 114 BT2
Trả lời câu hỏi Bài tập 2 trang 114 SGK Hóa 12 Chân trời sáng tạo
Tìm hiểu qua sách, báo hoặc internet, hãy cho biết 5 kim loại có độ dẫn điện và dẫn nhiệt tốt nhất. Qua đó rút ra nhận xét về độ dẫn điện và dẫn nhiệt của các kim loại chuyển tiếp thuộc dãy thứ nhất.
Phương pháp giải:
Đa số kim loại chuyển tiếp dãy thứ nhất có nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng, khối lượng riêng, độ dẫn điện, độ dẫn nhiệt cao.
Lời giải chi tiết:
- Các kim loại có độ dẫn điện, dẫn nhiệt tốt nhất: Ag, Cu, Au, Al, Na.
- Nhận xét: các kim loại chuyển tiếp thuộc dãy thứ nhất có độ dẫn điện và dẫn nhiệt cao.
CH tr 114 BT3
Trả lời câu hỏi Bài tập 3 trang 114 SGK Hóa 12 Chân trời sáng tạo
Để xác định hàm lượng của FeCO 3 trong quặng siderite, người ta có thể làm như sau: Cân 0,300 g mẫu quặng, xử lí theo một quỵ trình thích hợp, thu được dung dịch FeSO 4 trong môi trường H 2 SO 4 loãng. Coi như dung dịch không chứa tạp chất tác dụng với KMnO 4 . Chuẩn độ dung dịch thu được bằng dung dịch KMnO 4 0,02 M thì dùng hết 12,5 mL. Tính thành phần % theo khối lượng của FeCO 3 trong quặng.
Phương pháp giải:
Sử dụng phương trình hóa học sau
\(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Lời giải chi tiết:
Ta có: \({{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,02 \times {\rm{0,0125 = 0,00025 (mol)}}\)
Phương trình hóa học: \(10{\rm{FeS}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} \to {\rm{ }}5{\rm{F}}{{\rm{e}}_{\rm{2}}}{\left( {{\rm{S}}{{\rm{O}}_{\rm{4}}}} \right)_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }} + {\rm{ }}2{\rm{MnS}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}8{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Theo phương trình hóa học: \({{\rm{n}}_{{\rm{FeS}}{{\rm{O}}_4}}}{\rm{ = 5}}{{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 5 \times 0,00025 = 0,00125{\rm{ (mol)}}\)
Bảo toàn nguyên tố Fe: \({{\rm{n}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}{{\rm{n}}_{{\rm{FeS}}{{\rm{O}}_4}}} = 0,00125{\rm{ (mol)}}\)
\( \Rightarrow {{\rm{m}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}0,00125 \times 116 = 0,145{\rm{ (g)}}\)
\( \Rightarrow \% {{\rm{m}}_{{\rm{FeC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}\frac{{0,145}}{{0,3}} \approx 48,3\% \)