Bài 4. Dung dịch và nồng độ trang 13, 14, 15, 16 Vở thực hành khoa học tự nhiên 8
Quan sát hiện tượng xảy ra trong thí nghiệm
4.1
Quan sát hiện tượng xảy ra trong thí nghiệm Nhận biết dung dịch, chất tan và dung môi (trang 20, SGK KHTN 8) và trả lời các câu hỏi sau:
1. Trong các cốc (1), (2), (3), cốc nào chứa dung dịch?
Dựa vào dấu hiệu nào để nhận biết?
Chỉ ra chất tan, dung môi trong dung dịch thu được
2. Phần dung dịch ở cốc (4) có phải là dung dịch bão hòa ở nhiệt độ phòng không? Giải thích
Phương pháp giải:
Dựa vào hiện tượng trong thí nghiệm Nhận biết dung dịch, chất tan và dung môi
Lời giải chi tiết:
1. Cốc (1), (2) cốc chứa dung dịch. Do nó là hỗn hợp đồng nhất giữa chất tan và dung môi (nước) chất tan, dung môi trong các dung dịch thu được là
|
Chất tan |
Dung môi |
|
|
Cốc 1 |
Muối ăn |
Nước |
|
Cốc 2 |
Copper (II) Sulfat |
Nước |
2. Phần dung dịch ở cốc (4) là dung dịch bão hoà ở nhiệt độ phòng. Do dung dịch đó không thể hoà tan thêm chất tan (muối ăn) được nữa.
4.2
Hãy nêu cách pha dung dịch bão hòa sodium carbonate (Na 2 CO 3 ) trong nước
Phương pháp giải:
Dựa vào kiến thức về chất tan, dung môi và dung dịch làm thí nghiệm quan sát và trả lời câu hỏi
Lời giải chi tiết:
Chuẩn bị một cốc nước cho dần dần và liên tục muối sodium carbonate (Na 2 CO 3 ) vào trong cốc nước, khuấy nhẹ đến bao giờ không thể hòa tan thêm muối nữa thì ta thu được dung dịch sodium carbonate (Na 2 CO 3 ) bão hòa
4.3
Ở nhiệt độ 25°C, khi cho 12 gam muối X vào 20 gam nước, khuấy kĩ thì còn lại 5 gam muối không tan. Tính độ tan của muối X.
Phương pháp giải:
Dựa vào công thức tính độ tan của chất trong dung dịch: S = (m chất tan : m nước). 100
Lời giải chi tiết:
Độ tan của muối X bằng S = (12 – 5) : 20.100 = 35 (g/100g H2O)
4.4
Ở 18°C, khi hoà tan hết 53 gam Na 2 CO 3 trong 250 gam nước thì được dung dịch bão hoà. Tính độ tan của Na 2 CO 3 trong nước ở nhiệt độ trên.
Phương pháp giải:
Dựa vào công thức tính độ tan của chất trong dung dịch:
S = (m chất tan : m nước). 100
Lời giải chi tiết:
Độ tan của Na 2 CO 3 trong nước ở 18 độ C là: S = (53 : 250).100 = 21,2 (g/100g H2O)
4.5
Tính khối lượng H 2 SO 4 có trong 20 gam dung dịch H 2 SO 4 98%.
Phương pháp giải:
Dựa vào công thức tính nồng độ phần trăm của dung dịch (C%)
C% = (m ct : m dd) x 100
Lời giải chi tiết:
Khối lượng H 2 SO 4 có trong 20 gam dung dịch H 2 SO 4 98%:
C% = (m chất tan : m dung dịch) x 100
- m chất tan H 2 SO 4 = (m dd x C) : 100 = (20 x 98) : 100 = 19,6 (gam)
4.6
Trộn lẫn 2 lít dung dịch urea 0,02 M (dung dịch A) với 3 lít dung dịch urea 0,1M (dung dịch B), thu được 5 lít dung dịch C.
a) Tính số mol urê trong dung dịch A, B và C.
b) Tính nồng độ mol của dung dịch C. Nhận xét về giá trị nồng độ mol của dung dịch C so với nồng độ mol của dung dịch A, B.
Phương pháp giải:
Dựa vào công thức tính nồng độ mol: C M = n : V (mol/l)
Lời giải chi tiết:
a. Số mol urea trong dung dịch A = C M x V = 2 x 0,02 = 0,04 mol
Số mol urea trong dung dịch B = C M x V = 0,1 x 3 = 0,3 mol
Số mol urea trong dung dịch C = 0,3 + 0,04 = 0,34 mol
b. Tổng thể tích của dung dịch C = 2 + 3 = 5 lít
Nồng độ mol dung dịch C = n : V = 0,34 : 5 = 0,068 (mol/l)
Nhận xét:
Giá trị nồng độ mol của dung dịch C lớn hơn nồng độ mol của dung dịch A và nhỏ hơn nồng độ mol của dung dịch B.
4.7
Tiến hành thí nghiệm Pha 100 gam dung dịch muối ăn nồng độ 0,9% (trang 22 và 23 SGK KHTN 8) và trả lời câu hỏi:
1. Tại sao phải dùng muối ăn khan để pha dung dịch?
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng để làm gì?
Phương pháp giải:
Dựa vào các kiến thức đã học về dung dịch và chất tan
Lời giải chi tiết:
1. Dùng muối ăn khan để pha dung dịch dung dịch vì nếu trong muối ăn có chứa nước thì công thức tính toán khối lượng nước cần thêm vào để hoà tan muối sẽ phức tạp, gây sai số nhiều hơn.
2. Nước muối sinh lý 0,9% được sử dụng để điều trị hoặc ngăn ngừa tình trạng mất muối bởi tình trạng mất nước do tiêu chảy, sau phẫu thuật, đổ mồ hôi quá nhiều …
Dung dịch sodium chloride đẳng trương (0,9%) được dùng rộng rãi để thay thế dịch ngoại bào và trong xử lý nhiễm kiềm chuyển hóa có mất dịch và giảm natri nhẹ; và là dịch dùng trong thẩm tách máu, dùng khi bắt đầu và kết thúc truyền máu.
4.8
Hai đồ thị sau cho biết độ tan của oxygen trong nước tinh khiết và trong nước biển ở các nhiệt độ và áp suất khác nhau
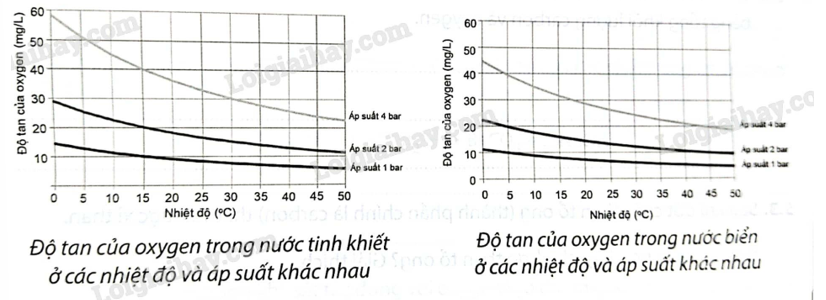
Từ các đồ thị trên hãy đưa ra nhận xét:
a) Khi nhiệt độ tăng, độ tan của oxygen trong nước tinh khiết thay đổi thế nào?
b) Khi áp suất tăng, độ tan của oxygen trong nước tinh khiết thay đổi thế nào?
c) So sánh độ tan của oxygen trong nước tinh khiết và nước biển ở
5 o C, 1 at
30 o C, 4atm
Phương pháp giải:
Dựa vào kiến thức về độ tan của chất trong dung dịch
Lời giải chi tiết:
a) Theo đồ thị độ tan của oxygen trong nước tinh khiết, ta thấy khi tăng nhiệt độ, độ tan của oxygen giảm dần
b) Theo đồ thị độ tan của oxygen trong nước biển, ta thấy khi tăng nhiệt độ độ tan của oxygen trong nước biển giảm dần
c)
|
Nhiệt độ, áp suất |
Độ tan oxygen tinh khiết |
Độ tan oxygen trong nước biển |
|
5 o C, 1 atm |
10 < S < 15 |
S = 10 |
|
30 0 C, 4 atm |
S = 30 |
20 < S < 30 |