Bài 4. Sơ lược về bảng tuần hoàn các nguyên tố hóa học trang 17, 18, 19 Vở thực thành khoa học tự nhiên 7
Gắn 18 thẻ nguyên tố vào bảng mẫu trong hoạt động Sắp xếp các nguyên tố hoá học và nhận xét về đặc điểm của bảng Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
CH tr 17 4.1
Gắn 18 thẻ nguyên tố vào bảng mẫu trong hoạt động Sắp xếp các nguyên tố hoá học và nhận xét về đặc điểm của bảng
1.Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng từ trái qua phải.
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột.
Phương pháp giải:
Tiến hành quan sát số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong bảng mẫu
Lời giải chi tiết:
Trong 1 hàng từ phải qua trái số electron ở lớp ngoài cùng tăng dần
Trong 1 cột từ trên xuống dưới số electron ở lớp ngoài cùng giống nhau
CH tr 17 4.2
Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
Phương pháp giải:
Quan sát mô hình cấu tạo nguyên tử các nguyên tố
Kết hợp sử dụng bảng tuần hoàn
Lời giải chi tiết:
Dựa vào số electron ở lớp ngoài cùng để sắp xếp các nguyên tố vào 1 cột, dựa vào số lớp electron để sắp xếp vào 1 hàng.
CH tr 17 4.3
Sử dụng bảng tuần hoàn hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
Phương pháp giải:
Dựa vào Bảng tuần hoàn, quy tắc sắp xếp nguyên tố trong bảng tuần hoàn
Lời giải chi tiết:
Theo quy tắc sắp xếp các nguyên tố trong bảng tuần hoàn thì:
Trong 1 hàng từ trái qua phải các nguyên tố mà trong nguyên tử có cùng số lớp electron . Như vậy nguyên tố C,O có số lớp electron bằng nhau
CH tr 17 4.4
quan sát hình 4.2 sách giáo khoa KHTN 7 cho biết số proton, số electron trong nguyên tử Oxygen
Phương pháp giải:
Quan sát hình 4.2 ; số p = số e
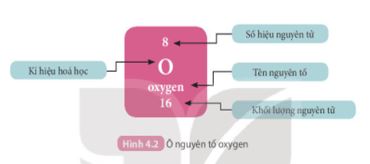
Lời giải chi tiết:
Từ hình 4.2 cho ta thấy trong nguyên tử oxygen có số p= số e=8
CH tr 17 4.5
Sử dụng bảng nguyên tố và cho biết kí hiệu hoá học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6,11
Phương pháp giải:
Quan sát ô số 6, ô số 11 trong bảng tuần hoàn
Dựa vào ở 1 ô nguyên tố cho biết: Số Z, KHHH, tên nguyên tố và khối lượng nguyên tử của nguyên tố đó
Biết số Z = số thứ tự Ô = số p = số e

Lời giải chi tiết:
-Ở ô số 6: +KHHH là C
+Tên nguyên tố: carbon
+Số Z= số e = 6
+Khối lượng nguyên tử: 12
-Ở ô số 11: + KHHH là Na
+Tên nguyên tố : Sodium (natri)
+Số Z = số e = 11
+Khối lượng nguyên tử 23
CH tr 17 4.6
Quan sát mô hình đã chuẩn bị trong hoạt động tìm hiểu mối quan hệ giữa số lớp electron của các nguyên tử các nguyên tố so với số thứ tự chu kỳ
1.Hãy cho biết số lớp electron của nguyên tử các nguyên tố trên.
2.So sánh số lớp electron của nguyên tử các nguyên tố trên với số thứ tự chu kỳ của các nguyên tố đó
Phương pháp giải:
Quan sát mô hình chuẩn bị
Lời giải chi tiết:
- Số lớp electron của Sodium là: 3 lớp
- Số lớp electron của Aluminium (nhôm) : 3 lớp
- Số lớp electron của Lithium : 2 lớp
- Số lớp electron của Carbon : 2 lớp
2. Từ mô hình ta thấy được : số thứ tự chu kì bằng với số lớp electron
Na, Al thuộc chu kì 3
Li,C thuộc chu kỳ 2
CH tr 18 4.7
Quan sát hình 4.3 SGK KHTN 7 cho biết tên, khhh, điện tích hạt nhân của nguyên tử các nguyên tố xung quanh nguyên tố carbon
Phương pháp giải:
Dựa vào hình 4.3

Lời giải chi tiết:
Xung quanh carbon có 3 nguyên tố là boron, nitrogen, silicon.
Boron (kí hiệu là B) có điện tích hạt nhân +5.
Nitrogen (kí hiệu là N) có điện tích hạt nhân là +7.
Silicon (kí hiệu là Si) có điện tích hạt nhân là +14.
CH tr 18 4.8
Hãy cho biết số electron của các nguyên tử các nguyên tố thuộc chu kỳ 3. Giải thích
Phương pháp giải:
Dựa vào nguyên tác sắp xếp các nguyên tố trong 1 chu kỳ
Lời giải chi tiết:
Ở chu kỳ 3 số lớp electron của các nguyên tử các nguyên tố đều có 3 lớp electron, số electron lớp ngoài cùng tăng dần từ trái qua phải
Giải thích: Vì số thứ tự chu kỳ bằng với số lớp electron nên ở chu kỳ 3 của các nguyên tử các nguyên tố sẽ có 3 lớp electron
CH tr 18 4.9
Quan sát các mô hình đã chuẩn bị trong hoạt động tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố so với số thứ tự của nhóm
1.Hãy cho biết nguyên tử các nguyên tố nào có cùng số lớp electron ở lớp ngoài cùng.
2.Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó
Phương pháp giải:
Quan sát mô hình, nguyên tắc sắp xếp các nguyên tố trong 1 nhóm
Lời giải chi tiết:
1.Nguyên tử của các nguyên tố có cùng số electron lớp ngoài cùng là
Na, Li (1e) ; N,P (3e)
2. Số electron lớp ngoài cùng = 8 – stt nhóm (đối với các nhóm A)
CH tr 18 4.10
Sử dụng bảng tuần hoàn, cho biết:
1.Số electron lớp ngoài cùng của nguyên tử 2 nguyên tố Al và S. Giải thích.
2. hãy kể tên nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố beryllium.
Phương pháp giải:
Sử dụng bảng tuần hoàn
Lời giải chi tiết:
1.Số electron lớp ngoài cùng của nguyên tử 2 nguyên tố Al và S là khác nhau vì Al và S đều thuộc chu kỳ 3 nên số lớp electron như nhau nhưng khác nhau số electron lớp ngoài cùng.
2.Chu kỳ nhỏ: Li,B,C,N,O,F,Ne.
Các nguyên tố trong cùng 1 nhóm với beryllium : Mg, Ca, Sr, Ba, Ra.
CH tr 19 4.11
Sử dụng bảng tuần, hãy xác định vị trí ( Stt, chu kỳ, nhóm) của các nguyên tố Al, Ca, Na.
|
Nguyên tố |
Số thứ tự |
Chu kỳ |
Nhóm |
|
Al |
|||
|
Ca |
|||
|
Na |
Phương pháp giải:
Dựa vào bảng tuần hoàn
Lời giải chi tiết:
|
Nguyên tố |
Số thứ tự |
Chu kỳ |
Nhóm |
|
Al |
13 |
3 |
IIIA |
|
Ca |
19 |
4 |
IIA |
|
Na |
11 |
3 |
IA |
CH tr 19 4.12
Tính chất nào của Nhôm, sắt, đồng đã được dùng trong các ứng dụng trong hình 4.6 Sgk KHTN 7
Phương pháp giải:
Sử dụng hình 4.6
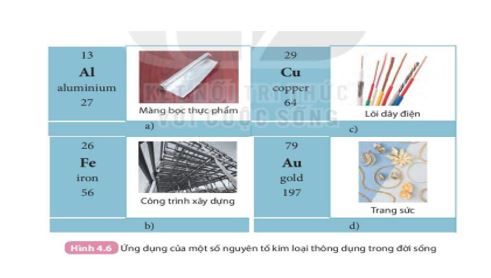
Lời giải chi tiết:
Al được dùng nằm màng bọc thực phẩm vì Al dễ dát mỏng, nhẹ, dẫn nhiệt tốt.
Cu được dùng làm lõi dây điện vì Cu dẫn điện tốt.
Fe được dùng trong các công trình xây dựng vì sắt cứng, chịu lực tốt.
CH tr 19 4.13
Sử dụng bảng tuần, hãy xác định vị trí ( Stt, chu kỳ, nhóm) của các nguyên tố có tên trong hình 4.7 Sgk KHTN 7
|
Nguyên tố |
Số thứ tự |
Chu kỳ |
Nhóm |
|
O |
|||
|
S |
|||
|
Cl |
|||
|
Br |
Phương pháp giải:
Sử dụng bảng tuần hoàn
Lời giải chi tiết:
|
Nguyên tố |
Số thứ tự |
Chu kỳ |
Nhóm |
|
O |
8 |
2 |
VIA |
|
S |
16 |
3 |
VIA |
|
Cl |
17 |
3 |
VIIA |
|
Br |
35 |
4 |
VIIA |
CH tr 19 4.14
Sử dụng bảng tuần, hãy xác định vị trí ( Stt, chu kỳ, nhóm) của khí hiếm Neon.
Phương pháp giải:
Sử dụng bảng tuần hoàn
Lời giải chi tiết:
Khí hiếm Neon ở Ô số 10, Chu kỳ 2, Nhóm VIIIA
CH tr 19 4.15
Bảng tuần hoàn các nguyên tố hoá học gồm các nguyên tố
A, Kim loại và phi kim
B, Phi kim và khí hiếm
C, Kim loại và khí hiếm
D, Kim loại, phi kim và khí hiếm
Lời giải chi tiết:
Đáp án: D
CH tr 20 4.16
Cho các nguyên tố sau: P, Ba, Rb, Cu, Fe , Ne, Si.
a.Sử dụng bảng tuần hoàn hãy cho biết: Trong các nguyên tố trên nguyên tố nào là kim loại , nguyên tố nào là phi kim?
b. Nêu ứng dụng trong đời sống của 1 nguyên tố trong số các nguyên tố trên
Phương pháp giải:
a.Sử dụng bảng tuần hoàn
b.Dựa vào kiến thức thực tiễn
Lời giải chi tiết:
a.Những nguyên tố trên là kim loại: Ba, Rb, Cu, Fe
Những nguyên tố trên là phi kim: P, Si
b. Ứng dụng của nguyên tố sắt trong đời sống
Làm đồ dùng cá nhân như: dao, kéo, kệ sắt, các lại dụng cụ gia đình khác. Sắt được dùng trong các đồ dùng nội thất như: khung cửa, cầu thang, tủ kệ,…các loại máy móc trong gia đình như: máy xay, máy giặt,..
CH tr 20 4.17
Hãy giải thích sơ lược ý nghĩa của sự tuần hoàn tính chất các nguyên tố thể hiện qua chu kỳ 2 và 3.
Phương pháp giải:
Dựa vào bảng tuần hoàn hoá học
Nguyên tắc sắp xếp các nguyên tố ở 1 chu kỳ
Lời giải chi tiết:
Chu kỳ 2 và 3 được gọi là chu kỳ nhỏ
Ý nghĩa : chu kì 2 và 3 cho ta biết theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm, tính phi kim tăng dần
Ở chu kỳ 2 và 3
CH tr 18 4.18
Vì sao các nguyên tố Fluorine và chlorine có tính chất khá giống nhau?
Phương pháp giải:
Dựa vào bảng tuần hoàn, Tính chất các nguyên tố được xếp vào cùng một cột
Lời giải chi tiết:
Hai nguyên tố Fluorine và chlorine có tính chất khá giống nhau vì chúng có số electron lớp ngoài cùng giống nhau đều là 7e nên chỉ nhận thêm 1e để tạo thành lớp vỏ bền như khí hiếm