Bài 6. Giới thiệu về liên kết hóa học trang 23, 24 Vở thực thành khoa học tự nhiên 7
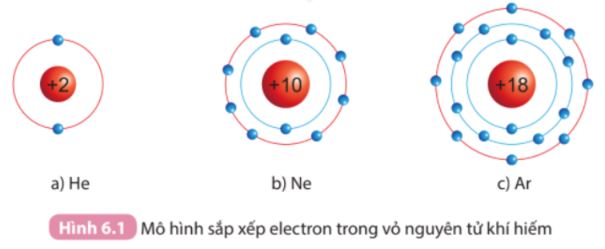
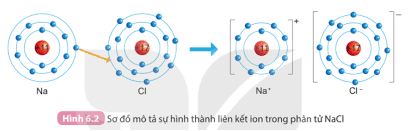
Quan sát hình 6.1 SGK KHTN 7 và so sánh số electron lớp ngoài cùng của He, Ne và Ar. Quan sát hình 6.2 SGK KHTN 7 và so sánh số electron lớp ngoài cùng của nguyên tử Na, Cl và Na+, Cl-
CH tr 23 6.1
Quan sát hình 6.1 SGK KHTN 7 và so sánh số electron lớp ngoài cùng của He, Ne và Ar.
Phương pháp giải:
Sử dụng hình 6.1 SGK
Lời giải chi tiết:
- He có 2 electron lớp ngoài cùng.
- Ne và Ar đều có 8 electron lớp ngoài cùng.
CH tr 23 6.2
Quan sát hình 6.2 SGK KHTN 7 và so sánh số electron lớp ngoài cùng của nguyên tử Na, Cl và Na + , Cl -
Phương pháp giải:
Sử dụng Hình 6.2 SGK
Lời giải chi tiết:
- Số electron ở lớp ngoài cùng của Na là 1, còn số electron ở lớp ngoài cùng của ion Na + là 8.
- Số electron ở lớp ngoài cùng của Cl là 7, còn số electron ở lớp ngoài cùng của ion Cl - là 8.
CH tr 23 6.3
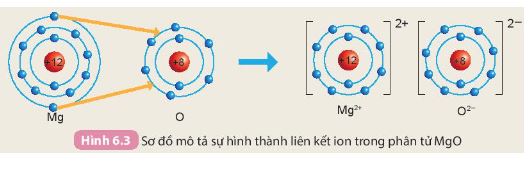
: Quan sát hình 6.3 SGK KHTN 7 ( Sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide), Cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron
Phương pháp giải:
Sử dụng hình 6.3 SGK KHTN 7
Lời giải chi tiết:
Nguyên tử Mg có 2 electron ở lớp ngoài cùng. Khi hình thành liên kết ion trong phân
tử magnesium oxide, nguyên tử Mg đã nhường 2 electron này cho nguyên tử O.
CH tr 23 6.4
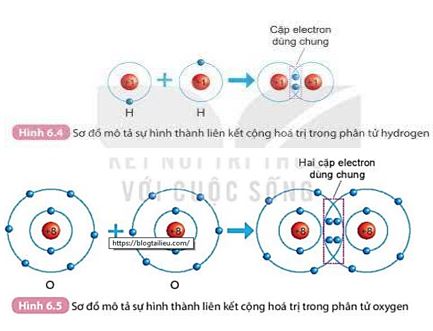
Quan sát hình 6.4 và hình 6.5 SGK KHTN 7, cho biết số electron lớp ngoài cùng của H và O trước và sau khi hình thành liên kết cộng hoá trị
Phương pháp giải:
Quan sát kĩ 2 hình trong SGK
Lời giải chi tiết:
- H: Số electron lớp ngoài cùng trước và sau khi hình thành liên kết cộng hóa trị lần lượt là 1 và 2.
- O: Số electron lớp ngoài cùng trước và sau khi hình thành liên kết cộng hóa trị lần lượt là 6 và 8
CH tr 23 6.5
Hãy mô tả sự hình thành liên kết cộng hoá trị trong phân tử chlorine, khí nitrogen.
Phương pháp giải:
Vẽ mô hình cấu tạo nguyên tử chlorine, nitrogen =>Tìm ra số electron lớp ngoài cùng
Dựa vào số electron lớp ngoài cùng của khí hiếm gần để giải thích sự hình thành liên kết cộng hoá trị trong phân tử chlorine, khí nitrogen.
Lời giải chi tiết:
- Cl 2 : Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Trong phân tử Cl 2 , mỗi nguyên tử Cl góp chung 1 electron ở lớp ngoài cùng của nó tạo thành 1 cặp electron dùng chung. Như vậy, mỗi nguyên tử Cl đều có 8 electron ở lớp ngoài cùng, giống khí hiếm Ar.
- N 2 : Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Trong phân tử N 2 , mỗi nguyên tử N góp chung 3 electron ở lớp ngoài cùng để tạo thành 3 cặp electron dùng chung. Mỗi nguyên tử N đều có 8 electron ở lớp ngoài cùng, giống khí hiếm Ne.
CH tr 24 6.6
Quan sát hình 6.6 SGK KHTN 7, cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử O giống với lớp vỏ của nguyên tử khí hiếm nào?
Phương pháp giải:
Sử dụng bảng tuần hoàn oxygen gần khí hiếm nào nhất
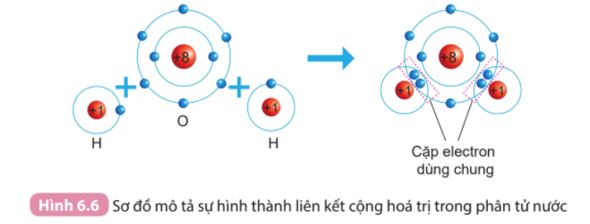
Lời giải chi tiết:
Khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen có 8 electron giống với lớp vỏ của nguyên tử khí hiếm gần nhất là neon (Ne).
CH tr 24 6.7
Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammoniac.
- CO 2 : ………………………………………………..
- NH 3 : ………………………………………………..
Phương pháp giải:
Dựa vào số electron lớp ngoài cùng của từng nguyên tử các nguyên tố trong phân tử để hình thành liên kết chúng đã nhường hay nhận bao nhiêu electron
Lời giải chi tiết:
- CO 2 : Nguyên tử C có 4 electron lớp ngoài cùng, mỗi nguyên tử O có 6 electron lớp ngoài cùng. Trong phân tử CO 2 , nguyên tử C nằm giữa 2 nguyên tử O, góp 4 electron lớp ngoài cùng của nó với 2 nguyên tử O. Mỗi nguyên tử O, góp 2 electron ở lớp ngoài cùng của nó cho nguyên tử C. Như vậy, có 4 cặp electron dùng chung giữa nguyên tử C với 2 nguyên tử O. Nguyên tử C và các nguyên tử O đều có 8 electron lớp ngoài cùng giống khí hiếm Ne.
- NH 3 : Nguyên tử N có 5 electron ở lớp ngoài cùng, nguyên tử H có 1 electron ở lớp ngoài cùng. Trong phân tử NH 3 , nguyên tử N nằm ở khoảng giữa các nguyên tử H, góp 3 electron lớp ngoài cùng của nó cho 3 nguyên tử H. Mỗi nguyên tử H góp 1 electron ở lớp ngoài cùng của nó với nguyên tử N. Như vậy, có 3 cặp electron dùng chung giữa nguyên tử N với 3 nguyên tử H. Nguyên tử N có 8 electron lớp ngoài cùng giống khí hiếm Ne; nguyên tử H có 2 electron lớp ngoài cùng giống khí hiếm He.
CH tr 24 6.8
Em hãy dự đoán xem ion Na + và nguyên tử Na có khác nhau về khối lượng hay không?Giải thích.
Phương pháp giải:
Khối lượng nguyên tử được tính bằng khối lượng hạt nhân nguyên tử, khối lượng electron vô cùng bé
Lời giải chi tiết:
Ion Na + và nguyên tử Na không khác nhau về khối lượng.
Giải thích:
Nguyên tử Na nhường 1 electron để được ion Na + . Khối lượng 1 electron là vô cùng nhỏ, không đáng kể
CH tr 24 6.9
Sự dùng chung electron liên kết trong phân tử oxygen, hydrogen và phân tử nước có giống nhau không? Hãy giải thích?
Phương pháp giải:
Dựa vào loại liên kết trong các phân tử trên
Mô hình hình thành liên kết các phân tử O 2 ,H 2 và H 2 O.
Lời giải chi tiết:
Sự dùng chung electron liên kết trong phân tử oxygen, hydrogen và phân tử nước là không giống nhau.
Cụ thể:
- O 2 : Liên kết cộng hóa trị được hình thành giữa 2 nguyên tử O bằng 2 cặp electron chung. Cặp electron chung không bị lệch về phía nguyên tử nào.
- H 2 : Liên kết cộng hóa trị được hình thành giữa 2 nguyên tử H bằng 1 cặp electron chung. Cặp electron chung không bị lệch về phía nguyên tử nào.
- H 2 O: Liên kết cộng hóa trị được hình thành giữa nguyên tử H và nguyên tử O bằng 1 cặp electron chung. Cặp electron chung bị lệch về phía nguyên tử O.