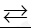Đề thi giữa kì 1 Hóa 11 Kết nối tri thức - Đề số 2
Phản ứng thuận nghịch là: A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Đề thi
Câu 1: Phản ứng thuận nghịch là:
A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
B. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
C. Phản ứng trong đó ở cùng điều kiện, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
D. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Câu 2: Cho phản ứng: \(CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(g)\) \({\Delta _r}H_{298}^0 > 0\)
Cân bằng phản ứng trên dịch chuyển theo chiều thuận khi
A. Giảm nhiệt độ
B. Tăng áp suất
C. Giảm nồng độ CO 2
D. Thêm chất xúc tác
Câu 3: Hằng số cân bằng K C của phản ứng chỉ phụ thuộc vào:
A. Nhiệt độ
B. Xúc tác
C. Nồng độ
D. Áp suất
Câu 4: Theo thuyết Bronsted – Lowry về acid – base, những chất có khả năng nhận H+ là:
A. acid B. base C. lưỡng tính D. muối
Câu 5: Trong dung dịch acid acetic (bỏ qua sự phân li của H 2 O) có những phần tử nào?
A. CH 3 OO - , H +
B. CH 3 COOH, H 2 O
C. CH 3 COOH, H + , H 2 O
D. CH 3 COO - , H + , H 2 O, CH 3 COOH
Câu 6: Cho phương trình: \(NH_4^ + + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3} + {H_3}{O^ + }\). Phát biểu nào sau đây là đúng?
A. NH 4 + là base
B. NH 4 + là acid
C. H 2 O là acid
D. H 3 O + là base
Câu 7: Trộn 200ml dung dịch H 2 SO 4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là:
A. 1,3 B. 4 C. 1 D. 3
Câu 8: Chuẩn độ 10ml dung dịch H 2 SO 4 chưa biết nồng độ đã dùng hết 20ml dung dịch KOH 0,1M. Nồng độ mol của dung dịch H 2 SO 4 là:
A. 0,2M B. 0,05M C. 0,1M D. 0,15M
Câu 9: Công thức hóa học của diêm tiêu Chile là:
A. Ca(NO 3 ) 2 B. NH 4 NO 3 C. NH 4 Cl D. NaNO 3
Câu 10: Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
A. NO B. N 2 O C. NH 3 D. NO 2
Câu 11: Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen B. Ammonnia C. Oxygen D. Hydrogen
Câu 12: Cho các nhận định sau: Phân tử ammonia và ion ammonium đều
(1) chứa liên kết cộng hóa trị
(2) là base Bronsted trong nước
(3) là acid Bronsted trong nước
(4) chứa nguyên tử N có số oxi hóa là -3
Số nhận định đúng là:
A. 2 B. 1 C. 4 D. 3
Câu 13: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH 3 thoát ra.
Câu 14: Mưa acid là hiện tượng nước mưa có PH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hòa trong nước). Hai tác nhân chính gây mưa acid là
A. Cl 2 , HCl B. N 2 , NH 3 C. SO 2 , NO x D. S, H 2 S
Câu 1 5 : Cho phản ứng sau: \(Al + HN{O_3} \to Al{(N{O_3})_{_3}} + {N_2}O + {H_2}O\)
Hệ số phản ứng của các chất lần lượt là:
A. 3, 15, 3, 1, 7
B. 8, 30, 8, 3, 15
C. 3, 30, 3, 8, 15
D. 8, 15, 8, 3, 15
II. Tự luận (4 điểm)
Câu 1 (2 điểm): Trong công nghiệp, hydrogen được sản xuất từ phản ứng:
\(C{H_4}(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3{H_2}(g) + CO(g)\)
(a) Tính hằng số cân bằng K C của phản ứng trên ở 760 o C. Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH 4 , H 2 O và CO ở trạng thái cân bằng lần lượt là 0,126M; 1,150M và 0,126M
(b) Ở 760 o C, giả sử ban đầu chỉ có CH 4 và H 2 O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H 2 ở trạng thái cân bằng là 0,6M
Câu 2 (2 điểm) Trộn 100ml dung dịch có pH =1 gồm HCl và HNO 3 với 100ml dung dịch NaOH nồng độ a (M) thu được 200ml dung dịch có pH = 12. Tính giá trị của a(M)
---Hết---
Đáp án
Phần trắc nghiệm
|
1A |
2C |
3A |
4B |
5D |
6B |
7C |
8C |
|
9D |
10A |
11B |
12A |
13B |
14C |
15B |
Câu 1: Phản ứng thuận nghịch là:
A. Phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
B. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
C. Phản ứng trong đó ở cùng điều kiện, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
D. Phản ứng trong đó ở điều kiện khắc nghiệt, xảy ra lần lượt sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng
Phương pháp
Dựa vào khái niệm của phản ứng thuận nghịch
Lời giải
Đáp án A
Câu 2: Cho phản ứng: \(CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(g)\) \({\Delta _r}H_{298}^0 > 0\)
Cân bằng phản ứng trên dịch chuyển theo chiều thuận khi
A. Giảm nhiệt độ
B. Tăng áp suất
C. Giảm nồng độ CO 2
D. Thêm chất xúc tác
Phương pháp
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học và nguyên lí chuyển dịch Le – Chatelier
Lời giải
Vì \({\Delta _r}H_{298}^0 > 0\)phản ứng thu nhiệt nên khi tăng nhiệt nhiệt độ cân bằng chuyển dịch theo chiều thuận
Vì số mol khí sản phẩm nhiều hơn tham gia nên khi tăng áp suất cân bằng chuyển dịch theo chiều nghịch
Khi giảm nồng độ CO 2 cân bằng chuyển dịch theo chiều thuận
Đáp án C
Câu 3: Hằng số cân bằng K C của phản ứng chỉ phụ thuộc vào:
A. Nhiệt độ
B. Xúc tác
C. Nồng độ
D. Áp suất
Phương pháp
Dựa vào kiến thức hằng số cân bằng
Lời giải
Hằng số cân bằng K C chỉ phụ thuộc vào nhiệt độ.
Câu 4: Theo thuyết Bronsted – Lowry về acid – base, những chất có khả năng nhận H + là:
A. acid B. base C. lưỡng tính D. muối
Phương pháp
Dựa vào thuyết Bronsted – Lowry
Lời giải
Những chất có khả năng nhận H + là base
=> Đáp án B
Câu 5: Trong dung dịch acid acetic (bỏ qua sự phân li của H 2 O) có những phần tử nào?
A. CH 3 OO - , H + B. CH 3 COOH, H 2 O
C. CH 3 COOH, H + , H 2 O D. CH 3 COO - , H + , H 2 O, CH 3 COOH
Phương pháp
Dựa vào phương trình phân li của chất điện li yếu
Lời giải
Chất điện li yếu phân li không hoàn toàn
=> Đáp án D
Câu 6: Cho phương trình: \(NH_4^ + + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3} + {H_3}{O^ + }\). Phát biểu nào sau đây là đúng?
A. NH 4 + là base B. NH 4 + là acid
C. H 2 O là acid D. H 3 O + là base
Phương pháp
Dựa vào thuyết Bronsted – Lowry
Lời giải
Trong phương trình, H 2 O nhận H + để thành H 3 O + , NH 4 + cho H + để trở thành NH 3 nên NH 4 + đóng vai trò là acid, H 2 O đóng vai trò base.
=> Đáp án B
Câu 7: Trộn 200ml dung dịch H 2 SO 4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là:
A. 1,3 B. 4 C. 1 D. 3
Phương pháp
Dựa vào công thức tính pH
Lời giải
\(\begin{array}{l}{n_{{H_2}S{O_4}}} = 0,2.0,05 = 0,01mol \to {n_{{H^ + }}} = 0,01.2 = 0,02mol\\{n_{HCl}} = 0,3.0,1 = 0,03mol \to {n_{{H^ + }}} = 0,03mol\\ \Rightarrow \sum {{n_{{H^ + }}} = 0,03 + 0,02 = 0,05mol} \to {\rm{[}}{H^ + }{\rm{]}} = \frac{{0,05}}{{0,2 + 0,3}} = 0,1M\\pH = - \lg ({\rm{[}}{H^ + }{\rm{]}}) = - \lg (0,1) = 1\end{array}\)
Câu 8: Chuẩn độ 10ml dung dịch H 2 SO 4 chưa biết nồng độ đã dùng hết 20ml dung dịch KOH 0,1M. Nồng độ mol của dung dịch H 2 SO 4 là:
A. 0,2M B. 0,05M C. 0,1M D. 0,15M
Phương pháp
Dựa vào công thức chuẩn độ acid – base
Lời giải
\(\begin{array}{l}2.{C_{{H_2}S{O_4}}}.{V_{{H_2}S{O_4}}} = {C_{KOH}}.{V_{KOH}} \to {C_{{H_2}S{O_4}}} = \frac{{{C_{KOH}}.{V_{KOH}}}}{2}\\ = \frac{{20.0,1}}{{10.2}} = 0,1M\end{array}\)
=> Đáp án C
Câu 9: Công thức hóa học của diêm tiêu Chile là:
A. Ca(NO 3 ) 2 B. NH 4 NO 3 C. NH 4 Cl D. NaNO 3
Lời giải
Công thức hóa học của diêm tiêu Chile: NaNO3
=> Đáp án D
Câu 10: Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
A. NO B. N 2 O C. NH 3 D. NO 2
Phương pháp
Khi liên kết ba trong nitrogen bị phá vỡ, nitrogen kết hợp với oxygen để tạo thành NO
Lời giải
=> Đáp án A
Câu 11: Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen B. Ammonnia C. Oxygen D. Hydrogen
Phương pháp
Liên kết hydrogen tạo bởi nguyên tử hydrogen với nguyên tử nitrogen
Lời giải
=> Đáp án B
Câu 12: Cho các nhận định sau: Phân tử ammonia và ion ammonium đều
(1) chứa liên kết cộng hóa trị
(2) là base Bronsted trong nước
(3) là acid Bronsted trong nước
(4) chứa nguyên tử N có số oxi hóa là -3
Số nhận định đúng là:
A. 2 B. 1 C. 4 D. 3
Phương pháp
Dựa vào kiến thức về phân tử ammonia và ion ammonium
Lời giải
(1) Đúng
(2) Sai vì NH 3 là base theo Bronsted, NH 4 + là acid theo Bronsted
(3) Sai NH 3 là base theo Bronsted, NH 4 + là acid theo Bronsted
(4) Đúng
=> Đáp án A
Câu 13: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH 3 thoát ra.
Phương pháp
Dựa vào kiến thức về muối ammonium
Lời giải
=> Đáp án B
Câu 14: Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hòa trong nước). Hai tác nhân chính gây mưa acid là
A. Cl 2 , HCl B. N 2 , NH 3 C. SO 2 , NO x D. S, H 2 S
Phương pháp
Mưa acid được gây nên do các khí có tính acid khi hòa tan vào nước
Lời giải
=> Đáp án C
Câu 1 5 : Cho phản ứng sau: \(Al + HN{O_3} \to Al{(N{O_3})_{_3}} + {N_2}O + {H_2}O\)
Hệ số phản ứng của các chất lần lượt là:
A. 3, 15, 3, 1, 7
B. 8, 30, 8, 3, 15
C. 3, 30, 3, 8, 15
D. 8, 15, 8, 3, 15
Phương pháp
Dựa vào phương pháp thăng bằng electron
Lời giải
\(\begin{array}{l}\mathop {Al}\limits^o \to A{l^{3 + }} + 3e|x8e\\2{N^{ + 5}} + 8e \to 2{N^{ + 1}}|x3e\\8Al + 30HN{O_3} \to 8Al{(N{O_3})_{_3}} + 3{N_2}O + 15{H_2}O\end{array}\)
=> Đáp án B
Phần tự luận
Câu 1 (2 điểm): Trong công nghiệp, hydrogen được sản xuất từ phản ứng:
\(C{H_4}(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3{H_2}(g) + CO(g)\)
(a) Tính hằng số cân bằng K C của phản ứng trên ở 760 o C. Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH 4 , H 2 O và CO ở trạng thái cân bằng lần lượt là 0,126M; 1,150M và 0,126M
(b) Ở 760 o C, giả sử ban đầu chỉ có CH 4 và H 2 O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H 2 ở trạng thái cân bằng là 0,6M
Lời giải
\((a){K_C} = \frac{{{{{\rm{[}}{H_2}]}^3}[CO]}}{{{\rm{[}}C{H_4}]{\rm{[}}{H_2}O]}} = \frac{{1,{{150}^3}.0,126}}{{0,126.0,242}} = 6,28\)
b)
|
CH 4 (g) + |
H 2 O(g) |
|
3H 2 (g) + CO(g) |
|
Ban đầu |
x |
x |
0 0 |
|
Phản ứng |
0,2 |
\( \leftarrow \)0,2 |
0,6 \( \to \) 0,2 |
|
Cân bằng |
x – 0,2 |
x – 0,2 |
0,6 0,2 |
K C = \(\begin{array}{l}\frac{{{{{\rm{[}}{H_2}]}^3}.{\rm{[}}CO]}}{{{\rm{[}}C{H_4}].{\rm{[}}{H_2}O]}} = 6,28 = \frac{{0,{6^3}.0,2}}{{(x - 0,2).(x - 0,2)}}\\ \Rightarrow {x_1} = 0,238;{x_2} = 0,117\end{array}\)
Loại x 2 vì x > 0,2
Câu 2 (2 điểm): Trộn 100ml dung dịch có pH =1 gồm HCl và HNO 3 với 100ml dung dịch NaOH nồng độ a (M) thu được 200ml dung dịch có pH = 12. Tính giá trị của a(M)
Lời giải
\(\begin{array}{l}pH = 1 \to {\rm{[}}{H^ + }{\rm{] = 1}}{{\rm{0}}^{ - 1}}M \to {n_{{H^ + }}} = {10^{ - 1}}.0,1 = {10^{ - 2}}\\{H^ + } + O{H^ - } \to {H_2}O\end{array}\)
10 -2 0,1a
Vì thu được dung dịch có pH =12 à NaOH dư --> [OH - ]= 10 -2 --> n OH - dư = 10 -2 .0,2=0,002 mol
Có n OH - dư :\(0,002 = 0,1a - {10^{ - 2}} \to a = 0,12M\)