Đề thi giữa kì 1 KHTN 7 Cánh diều - Đề số 11
Đề thi giữa kì 1 - Đề số 11
Đề bài
Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rơ - dơ-pho- Bo
-
A.
Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử
-
B.
Nguyên tử có cấu tạo đặc khít, gồm hạt nhân nguyên tử và các electron.
-
C.
Electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định tạo thành các lớp electron
-
D.
Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
Phát biểu nào sau đây không mô tả đúng vỏ nguyên tử theo mô hình nguyên tử của Rơ-dơ-pho - Bo?
-
A.
Electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau tạo thành các lớp electron.
-
B.
Lớp electron trong cùng gần hạt nhân nhất có tối đa 2 electron, các lớp electron khác có chứa tối đa 8 electron hoặc nhiều hơn.
-
C.
Lớp electron trong cùng gần hạt nhân nhất có tối đa 8 electron, các lớp electron khác có chứa tối đa nhiều hơn 8 electron.
-
D.
Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
Kí hiệu của 3 hạt neutron, proton, electron lần lượt là:
-
A.
n, p, e .
-
B.
e, p, n
-
C.
n, e, p
-
D.
p, n , e
Một nguyên tử có 10 proton trong hạt nhân. Theo mô hình nguyên tử của Ro-dơ-pho - Bo, số lớp electron của nguyên tử đó là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nitơ (nitrogen) là nguyên tố hoá học phổ biến trong không khí. Trong hạt nhân nguyên tử nitơ có 7 proton. Số electron trong các lớp của vỏ nguyên tử nitơ, viết từ lớp trong ra lớp ngoài, lần lượt là?
-
A.
7
-
B.
2,5.
-
C.
2,2,3.
-
D.
2,4,1.
Nguyên tử calcium có 20 electron ở vỏ nguyên tử. Hạt nhân của nguyên tử calcium có số proton là
-
A.
2
-
B.
10
-
C.
18
-
D.
20
Nguyên tử X có 16 proton. Vị trí của X trong bảng tuần hoàn là
-
A.
Chu kì 1 nhóm IA.
-
B.
Chu kì 3 nhóm VIA
-
C.
Chu kì 4 nhóm IA
-
D.
Chu kì 1 nhóm VIA.
Nguyên tử nguyên tố X có khối lượng phân tử là 2, biết số hạt proton là 1. Tìm số hạt neutron?
-
A.
0
-
B.
1
-
C.
2
-
D.
3
Số electron tối đa ở lớp electron thứ nhất là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Nguyên tử nhôm (aluminium) ở vị trí nhóm IIIA, chu kì 3 trong bảng tuần hoàn. Số electron ở lớp ngoài cùng của nguyên tử nhôm là
-
A.
3
-
B.
8
-
C.
10
-
D.
18
Trong hạt nhân nguyên tử lưu huỳnh (sulfur) có 16 proton. Số electron trong các lớp của vỏ nguyên tử sulfur, viết từ lớp trong ra lớp ngoài, lần lượt là
-
A.
2, 10, 6.
-
B.
2, 6, 8.
-
C.
2, 8, 6.
-
D.
2, 9, 5.
Đồng (copper) và carbon là các
-
A.
Hợp chất.
-
B.
Hỗn hợp.
-
C.
Nguyên tử thuộc cùng một nguyên tố hoá học.
-
D.
Nguyên tố hoá học.
Kí hiệu nào sau đây là kí hiệu hoá học của nguyên tố magnesium?
-
A.
MG.
-
B.
Mg.
-
C.
mg.
-
D.
mG.
Mặt trời chứa hydrogen, 25% helium và 2% các nguyên tố hóa học khác. Phần trăm nguyên tố hydrogen có trong Mặt Trời là
-
A.
27%.
-
B.
62%.
-
C.
25%.
-
D.
73%.
Tên gọi theo IUPAC của nguyên tố ứng với kí hiệu hóa học Na là
-
A.
Natri.
-
B.
Nitrogen.
-
C.
Natrium.
-
D.
Sodium.
Công thức hóa học của iron(III) oxide là Fe 2 O 3 . Nhận định nào sau đây là sai?
-
A.
Iron(III) oxide do hai nguyên tố Fe, O tạo ra.
-
B.
Trong một phân tử iron(III) oxide có hai nguyên tử Fe, ba nguyên tử O.
-
C.
Khối lượng phân tử iron(III) oxide là 160 amu.
-
D.
Trong phân tử iron(III) oxide tỉ lệ số nguyên tử Fe : O là 3 : 2.
Khi calcium chloride (CaCl 2 ) hoà tan vào nước, sẽ có cation Ca 2+ và anion Cl - trong dung dịch. Khi đó
-
A.
số ion Cl - gấp hai lần ion Ca 2+
-
B.
số ion Ca 2+ và Cl - bằng nhau.
-
C.
số ion Ca 2+ bằng số nguyên tử chlorine.
-
D.
số ion Cl - gấp hai lần số nguyên tử Ca.
Cho các chất: CO, NaCl, CaO, SO 2 , O 2 , K 2 O, BaBr 2 . Số chất chứa liên kết ion trong phân tử là
-
A.
2
-
B.
4
-
C.
5
-
D.
6
Nguyên tố Fe có hóa trị III, Cl có hóa trị I. Công thức hóa học của hợp chất tạo bởi Fe và Cl là:
-
A.
FeCl 3
-
B.
Fe 3 Cl
-
C.
FeCl
-
D.
FeCl3
Khối lượng phân tử của khí Chlorine (Cl 2 ) là:
-
A.
35,5 amu.
-
B.
32 amu
-
C.
71 amu
-
D.
56 amu.
Tốc độ của vật thể được tính bằng công thức nào?
-
A.
\(v = \frac{s}{t}\)
-
B.
v = s.t
-
C.
v = s – t
-
D.
v = s + t
Đơn vị của tốc độ trong hệ SI là gì?
-
A.
m/s
-
B.
km/h
-
C.
s
-
D.
cả A và B
Một xe đi được 60 km trong 2 giờ. Tốc độ trung bình của xe là bao nhiêu?
-
A.
15 km/h
-
B.
20 km/h
-
C.
30 km/h
-
D.
60 km/h
Nếu đồ thị quãng đường - thời gian là đường thẳng đi qua gốc tọa độ, điều này cho thấy
-
A.
Vận tốc thay đổi
-
B.
Chuyển động đều
-
C.
Tăng tốc
-
D.
Giảm tốc
Xe máy chạy với tốc độ trung bình 50 km/h. Để đi quãng đường 200 km, xe cần bao nhiêu thời gian?
-
A.
3 giờ
-
B.
4 giờ
-
C.
5 giờ
-
D.
6 giờ
Lời giải và đáp án
Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rơ - dơ-pho- Bo
-
A.
Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử
-
B.
Nguyên tử có cấu tạo đặc khít, gồm hạt nhân nguyên tử và các electron.
-
C.
Electron chuyển động xung quanh hạt nhân theo những quỹ đạo xác định tạo thành các lớp electron
-
D.
Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
Đáp án : B
Dựa vào cấu tạo nguyên tử.
B sai vì nguyên tử có cấu tạo rỗng, gồm hạt nhân nguyên tử và các electron.
Đáp án B
Phát biểu nào sau đây không mô tả đúng vỏ nguyên tử theo mô hình nguyên tử của Rơ-dơ-pho - Bo?
-
A.
Electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau tạo thành các lớp electron.
-
B.
Lớp electron trong cùng gần hạt nhân nhất có tối đa 2 electron, các lớp electron khác có chứa tối đa 8 electron hoặc nhiều hơn.
-
C.
Lớp electron trong cùng gần hạt nhân nhất có tối đa 8 electron, các lớp electron khác có chứa tối đa nhiều hơn 8 electron.
-
D.
Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
Đáp án : C
Dựa vào mô hình nguyên tử của Ro – dơ – pho – Bo
C sai vì lớp electron trong cùng gần hạt nhân nhất có tối đa 2 electron, các lớp khác có tối đa từ 8 đến nhiều hơn 8 electron.
Đáp án C
Kí hiệu của 3 hạt neutron, proton, electron lần lượt là:
-
A.
n, p, e .
-
B.
e, p, n
-
C.
n, e, p
-
D.
p, n , e
Đáp án : A
Dựa vào thành phần nguyên tử.
Kí hiệu của 3 hạt neutron, proton, electron: n, p, e
Đáp án A
Một nguyên tử có 10 proton trong hạt nhân. Theo mô hình nguyên tử của Ro-dơ-pho - Bo, số lớp electron của nguyên tử đó là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào mô hình nguyên tử của Ro – dơ – pho – Bo.
Vì p = e nên số electron của nguyên tử là 10 electron.
Lớp thứ nhất có tối đa 2 electron.
Lớp thứ hai có tối đa 8 electron.
Vậy 10 electron sẽ có 2 lớp electron.
Đáp án B
Nitơ (nitrogen) là nguyên tố hoá học phổ biến trong không khí. Trong hạt nhân nguyên tử nitơ có 7 proton. Số electron trong các lớp của vỏ nguyên tử nitơ, viết từ lớp trong ra lớp ngoài, lần lượt là?
-
A.
7
-
B.
2,5.
-
C.
2,2,3.
-
D.
2,4,1.
Đáp án : B
Dựa vào thành phần nguyên tử.
Vì p = e nên e = 7 electron.
Số electron trong các lớp vỏ nguyên tử nitrơ lần lượt là 2,5.
Đáp án B
Nguyên tử calcium có 20 electron ở vỏ nguyên tử. Hạt nhân của nguyên tử calcium có số proton là
-
A.
2
-
B.
10
-
C.
18
-
D.
20
Đáp án : D
Dựa vào p = e.
Vì Ca có 20 electron nên p = 20.
Đáp án D
Nguyên tử X có 16 proton. Vị trí của X trong bảng tuần hoàn là
-
A.
Chu kì 1 nhóm IA.
-
B.
Chu kì 3 nhóm VIA
-
C.
Chu kì 4 nhóm IA
-
D.
Chu kì 1 nhóm VIA.
Đáp án : B
Dựa vào số electron vào các lớp.
Vì p = e nên X có 16 electron.
Lớp thứ 1 có tối đa 2 electron.
Lớp thứ 2 có tối đa 8 electron.
Lớp thứ 3 có tối đa 18 electron.
Vậy X có 16 electron có 3 lớp electron, với lớp ngoài cùng có 6 electron.
Số lớp electron = chu kì.
Số electron lớp ngoài cùng = số nhóm
Vậy X ở chu kì 3 nhóm VIA.
Đáp án B
Nguyên tử nguyên tố X có khối lượng phân tử là 2, biết số hạt proton là 1. Tìm số hạt neutron?
-
A.
0
-
B.
1
-
C.
2
-
D.
3
Đáp án : B
Dựa vào thành phần nguyên tử.
Khối lượng phân tử = P + N = 2
Mà P = 1 nên N = 1
Đáp án B
Số electron tối đa ở lớp electron thứ nhất là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
Dựa vào mô hình nguyên tử Ro – dơ – pho – Bo.
Số electron tối đa ở lớp electron thứ nhất là 2.
Đáp án B
Nguyên tử nhôm (aluminium) ở vị trí nhóm IIIA, chu kì 3 trong bảng tuần hoàn. Số electron ở lớp ngoài cùng của nguyên tử nhôm là
-
A.
3
-
B.
8
-
C.
10
-
D.
18
Đáp án : A
Dựa vào sơ lược về bảng tuần hoàn hóa học.
Vì chu kì = số lớp electron; số nhóm = số electron lớp ngoài cùng.
Vậy Al có 3 electron lớp ngoài cùng.
Đáp án A
Trong hạt nhân nguyên tử lưu huỳnh (sulfur) có 16 proton. Số electron trong các lớp của vỏ nguyên tử sulfur, viết từ lớp trong ra lớp ngoài, lần lượt là
-
A.
2, 10, 6.
-
B.
2, 6, 8.
-
C.
2, 8, 6.
-
D.
2, 9, 5.
Đáp án : C
Dựa vào mô hình nguyên tử Ro – dơ – pho – Bo.
Lớp thứ nhất có tối đa 2 electron.
Lớp thứ hai có tối đa 8 electron.
Lớp thứ 3 có 6 electron.
Vậy số electron trong các lớp của vỏ nguyên tử sulfur lần lượt là 2,8,6.
Đáp án C
Đồng (copper) và carbon là các
-
A.
Hợp chất.
-
B.
Hỗn hợp.
-
C.
Nguyên tử thuộc cùng một nguyên tố hoá học.
-
D.
Nguyên tố hoá học.
Đáp án : D
Dựa vào nguyên tố hóa học.
Đồng và carbon là các nguyên tố hóa học.
Đáp án D
Kí hiệu nào sau đây là kí hiệu hoá học của nguyên tố magnesium?
-
A.
MG.
-
B.
Mg.
-
C.
mg.
-
D.
mG.
Đáp án : B
Dựa vào kí hiệu nguyên tố hóa học.
Magnesium có kí hiệu là Mg.
Đáp án B
Mặt trời chứa hydrogen, 25% helium và 2% các nguyên tố hóa học khác. Phần trăm nguyên tố hydrogen có trong Mặt Trời là
-
A.
27%.
-
B.
62%.
-
C.
25%.
-
D.
73%.
Đáp án : D
Dựa vào % các nguyên tố trong hợp chất.
Phần trăm nguyên tố hydrogen = 100 – 25 – 2 = 73%
Đáp án D
Tên gọi theo IUPAC của nguyên tố ứng với kí hiệu hóa học Na là
-
A.
Natri.
-
B.
Nitrogen.
-
C.
Natrium.
-
D.
Sodium.
Đáp án : D
Dựa vào danh pháp của nguyên tố hóa học.
Na có tên gọi là sodium.
Đáp án D
Công thức hóa học của iron(III) oxide là Fe 2 O 3 . Nhận định nào sau đây là sai?
-
A.
Iron(III) oxide do hai nguyên tố Fe, O tạo ra.
-
B.
Trong một phân tử iron(III) oxide có hai nguyên tử Fe, ba nguyên tử O.
-
C.
Khối lượng phân tử iron(III) oxide là 160 amu.
-
D.
Trong phân tử iron(III) oxide tỉ lệ số nguyên tử Fe : O là 3 : 2.
Đáp án : D
Dựa vào quy tắc hóa trị.
D sai, trong phân tử iron(III) oxide tỉ lệ số nguyên tử Fe : O = 2 : 3.
Đáp án D
Khi calcium chloride (CaCl 2 ) hoà tan vào nước, sẽ có cation Ca 2+ và anion Cl - trong dung dịch. Khi đó
-
A.
số ion Cl - gấp hai lần ion Ca 2+
-
B.
số ion Ca 2+ và Cl - bằng nhau.
-
C.
số ion Ca 2+ bằng số nguyên tử chlorine.
-
D.
số ion Cl - gấp hai lần số nguyên tử Ca.
Đáp án : A
Dựa vào liên kết hóa học.
Khi hoàn tan CaCl 2 vào nước ta thấy số ion Cl - gấp hai lần ion Ca 2+ .
Đáp án A
Cho các chất: CO, NaCl, CaO, SO 2 , O 2 , K 2 O, BaBr 2 . Số chất chứa liên kết ion trong phân tử là
-
A.
2
-
B.
4
-
C.
5
-
D.
6
Đáp án : B
Dựa vào liên kết hóa học.
NaCl, CaO, K 2 O, BaBr 2 là chất có chứa liên kết ion trong phân tử.
Đáp án B
Nguyên tố Fe có hóa trị III, Cl có hóa trị I. Công thức hóa học của hợp chất tạo bởi Fe và Cl là:
-
A.
FeCl 3
-
B.
Fe 3 Cl
-
C.
FeCl
-
D.
FeCl3
Đáp án : A
Dựa vào quy tắc hóa trị.
Công thức chung là Fe x Cl y
Theo quy tắc hóa trị: III.x = I.y
\( \to \)\(\frac{x}{y} = \frac{1}{3}\)
Công thức hóa học là FeCl 3
Đáp án A
Khối lượng phân tử của khí Chlorine (Cl 2 ) là:
-
A.
35,5 amu.
-
B.
32 amu
-
C.
71 amu
-
D.
56 amu.
Đáp án : C
Dựa vào khối lượng phân tử.
Khối lượng phân tử khí chlorine là: 35,5.2 = 71amu
Đáp án C
Tốc độ của vật thể được tính bằng công thức nào?
-
A.
\(v = \frac{s}{t}\)
-
B.
v = s.t
-
C.
v = s – t
-
D.
v = s + t
Đáp án : A
Dựa vào công thức tính tốc độ
Tốc độ của vật thể được tính bằng công thức \(v = \frac{s}{t}\)
Đáp án A
Đơn vị của tốc độ trong hệ SI là gì?
-
A.
m/s
-
B.
km/h
-
C.
s
-
D.
cả A và B
Đáp án : D
Dựa vào đơn vị tốc độ
Đơn vị của tốc độ trong hệ SI là m/s, km/h
Đáp án D
Một xe đi được 60 km trong 2 giờ. Tốc độ trung bình của xe là bao nhiêu?
-
A.
15 km/h
-
B.
20 km/h
-
C.
30 km/h
-
D.
60 km/h
Đáp án : C
Dựa vào công thức tính tốc độ
\[v = \frac{s}{t} = \frac{{60}}{2} = 30km/h\]
Đáp án C
Nếu đồ thị quãng đường - thời gian là đường thẳng đi qua gốc tọa độ, điều này cho thấy
-
A.
Vận tốc thay đổi
-
B.
Chuyển động đều
-
C.
Tăng tốc
-
D.
Giảm tốc
Đáp án : B
Dựa vào đồ thị quãng đường – thời gian
Nếu đồ thị quãng đường - thời gian là đường thẳng đi qua gốc tọa độ, điều này cho thấy chuyển động đều
Đáp án B
Xe máy chạy với tốc độ trung bình 50 km/h. Để đi quãng đường 200 km, xe cần bao nhiêu thời gian?
-
A.
3 giờ
-
B.
4 giờ
-
C.
5 giờ
-
D.
6 giờ
Đáp án : B
Dựa vào công thức tính tốc độ
Thời gian xe đi 200 km là: \(t = \frac{s}{v} = \frac{{200}}{{50}} = 4\)giờ
Đáp án B
|
Số p trong hạt nhân |
số e trong nguyên tử |
số lớp electron |
số e lớp ngoài cùng |
|
|
Nitrogen |
7 |
7 |
2 |
5 |
|
Magnesium |
12 |
12 |
3 |
2 |
a) Phần trăm của các nguyên tố hóa học ngoài hydrogen và helium có trong Mặt Trời là:
100% - 73% - 25% = 2%.
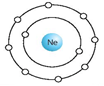
b) Vì trong nguyên tử, số electron bằng số proton nên số electron trong lớp vỏ nguyên tử là 10. Mô hình nguyên tử neon:
a. Al và O.
Công thức dạng chung là: Al x O y
Theo quy tắc hóa trị ta có: III.x = II.y
Chuyển tỉ lệ: \(\frac{x}{y} = \frac{{II}}{{III}} = \frac{2}{3}\)
Vậy x= 2, y =3 \( \to \) CTHH : Al 2 O 3
Khối lượng phân tử của Al 2 O 3 bằng: 27.2+16.3= 102 (amu)
b. Mg và O
Công thức dạng chung là: Mg x O y
Theo quy tắc hóa trị ta có: II.x = II.y
Chuyển tỉ lệ: \(\frac{x}{y} = \frac{{II}}{{II}} = \frac{2}{2} = \frac{1}{1}\)
Vậy x= 1, y = 1 \( \to \) CTHH : MgO
Khối lượng phân tử của MgO bằng: 24+16= 40 (amu)
c. Al và OH
Công thức dạng chung là: Al x (OH) y
Theo quy tắc hóa trị ta có: III.x = I.y
Chuyển tỉ lệ: \(\frac{x}{y} = \frac{I}{{III}} = \frac{1}{3}\)
Vậy x= 1, y =3 \( \to \) CTHH : Al(OH) 3
Khối lượng phân tử của Al(OH) 3 bằng: 27 +(16+1).3 = 78 (amu)
Tốc độ là yếu tố quan trọng trong giao thông, vì nó ảnh hưởng trực tiếp đến khả năng dừng xe, tránh va chạm và giảm thiểu thương tích khi xảy ra tai nạn. Khi xe di chuyển với tốc độ cao, quãng đường phanh cần thiết cũng dài hơn, khó kiểm soát xe trong các tình huống bất ngờ. Ngoài ra, tác động của lực va chạm tăng lên khi tốc độ tăng, gây nguy hiểm cho người tham gia giao thông. Vì vậy, việc giới hạn tốc độ là cần thiết để giảm nguy cơ tai nạn.