Đề thi học kì 2 Hóa 10 Cánh diều - Đề số 6
Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết khi các chất ở trạng thái nào?
Đề bài
Halogen nào là nguyên tố phi kim mạnh nhất trong bảng tuần hoàn?
-
A.
Chlorine.
-
B.
Bromine.
-
C.
Iodine.
-
D.
Fluorine.
Cho phản ứng hóa học sau: Cu + HNO 3 → Cu(NO 3 ) 2 + NO + H 2 O. Sau khi đã cân bằng, tỉ lệ hệ số phân tử bị khử và số phân tử bị oxi hóa là
-
A.
3:8
-
B.
2:3
-
C.
8:3
-
D.
3:2
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + 1/2O 2(g) → CO 2(g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Biết nhiệt tạo thành chuẩn của CO 2 là -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
-
A.
+221,0 kJ.
-
B.
-221,0 kJ.
-
C.
+110,5 kJ.
-
D.
–110,5 kJ.
Cho các yếu tố: nhiệt độ, áp suất, diện tích bề mặt tiếp xúc, chất xúc tác, nồng độ. Có bao nhiêu yếu tố có thể ảnh hưởng đến tốc độ của phản ứng?
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
-
A.
Nhận thêm 1 electron.
-
B.
Nhường đi 1 electron.
-
C.
Nhận thêm 2 electron.
-
D.
Nhường đi 7 electron.
Cho phản ứng hóa học: Fe + CuSO 4 → FeSO 4 + Cu. Trong phản ứng trên xảy ra
-
A.
sự khử Fe 2+ và sự oxi hóa Cu.
-
B.
sự khử Fe 2+ và sự khử Cu 2+ .
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự oxi hóa Fe và sự khử Cu 2+ .
Trong phòng thí nghiệm người ta thường điều chế chlorine bằng cách nào sau đây?
-
A.
Cho HCl đặc tác dụng với MnO 2 , KMnO 4 …
-
B.
Phân hủy khí HCl.
-
C.
Điện phân dung dịch NaCl có màng ngăn.
-
D.
Điện phân nóng chảy NaCl.
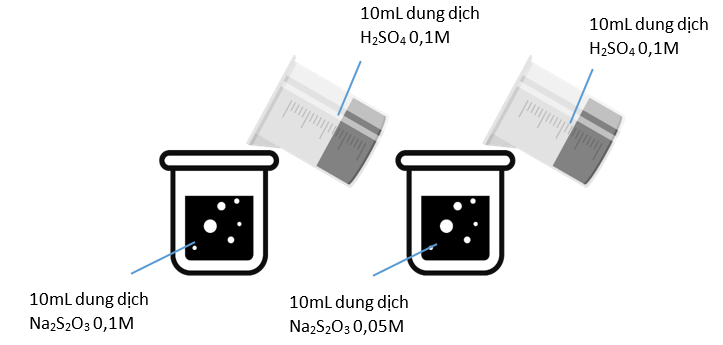
-
A.
Thí nghiệm bên trái có kết tủa xuất hiện trước.
-
B.
Thí nghiệm bên phải có kết tủa xuất hiện trước.
-
C.
Kết tủa xuất hiện đồng thời.
-
D.
Không có kết tủa xuất hiện.
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
-
A.
\(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)
-
B.
\(2A{l_{(s)}} + \frac{3}{2}{O_{2\,(g)}} \to A{l_2}{O_3}_{(s)}\,\,{\Delta _r}H_{298}^0 = - 1675,7\,kJ.\)
-
C.
\({C_2}{H_{4\,(g)}} + {H_{2\,(g)}} \to {C_2}{H_6}_{(g)}\,\,\,{\Delta _r}H_{298}^0 = - 137,0\,kJ.\)
-
D.
\({C_{(s)}} + {O_{2\,(g)}} \to C{O_{2\,(g)}}\,\,\,{\Delta _r}H_{298}^0 = - 393,5\,kJ.\)
Chất nào đây được dùng để diệt trùng nước sinh hoạt?
-
A.
Chlorine.
-
B.
Bromine.
-
C.
Oxygen.
-
D.
Nitrogen.
Khi được bảo quản trong tủ lạnh, thức ăn chậm bị ôi, thiu. Yếu tố ảnh hưởng đến quá trình phản ứng được vận dụng trong ví dụ trên là
-
A.
Nhiệt độ.
-
B.
Nồng độ.
-
C.
Áp suất.
-
D.
Diện tích bề mặt.
Trong dãy 4 dung dịch HF; HCl; HBr; HI. Ta thấy
-
A.
tính acid giảm dần từ trái sang phải.
-
B.
tính acid tăng dần từ trái sang phải.
-
C.
tính acid biến đổi không theo qui luật.
-
D.
tính acid không biến đổi.
Tốc độ phản ứng tại một thời điểm của phản ứng đơn giản 2A + B → C được tính bằng biểu thức: \(v = k.C_A^2.C_B^{}\). Hằng số tốc độ k phụ thuộc vào yếu tố nào trong các yếu tố sau?
-
A.
Nhiệt độ của phản ứng.
-
B.
Thời gian xảy ra phản ứng.
-
C.
Nồng độ của chất sản phẩm.
-
D.
Nồng độ của chất phản ứng.
Cho các phản ứng sau:
(a) 4HCl + PbO 2 → PbCl 2 + Cl 2 + 2H 2 O (b) HCl + NH 4 HCO 3 → NH 4 Cl + CO 2 + H 2 O
(c) 2HCl + 2HNO 3 → 2NO 2 + Cl 2 + 2H 2 O (d) 2HCl + Fe → FeCl 2 + H 2
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
-
A.
3
-
B.
4
-
C.
1
-
D.
2
Một phản ứng có hệ số nhiệt độ Van’t Hoff là γ = 3. Khi nhiệt độ tăng 10 o C, tốc độ của phản ứng trên sẽ
-
A.
tăng 3 lần.
-
B.
tăng 9 lần
-
C.
giảm 9 lần.
-
D.
giảm 3 lần.
Tính chất hóa học đặc trưng của các đơn chất halogen là
-
A.
tính oxi hóa.
-
B.
tính khử.
-
C.
tính acid.
-
D.
tính base.
Cho các phát biểu sau:
(1) Dung dịch HF là acid yếu và không được chứa trong lọ thuỷ tinh.
(2) Trong tự nhiên chlorine chủ yếu tồn tại ở dạng đơn chất.
(3) Dung dịch NaF loãng dùng làm thuốc chống sâu răn
(4) Đi từ F 2 tới I 2 nhiệt độ sôi tăng dần, nhiệt độ nóng chảy tăng dần, màu sắc đậm dần.
(5) Có thể điều chế Cl 2 bằng phản ứng đun nóng HCl đặc với KMnO 4 .
Số phát biểu đúng là
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Hóa chất nào sau đây thường dùng để nhận biết I 2 ?
-
A.
Phenolphtalein .
-
B.
Hồ tinh bột .
-
C.
Quỳ tím.
-
D.
Nước vôi trong .
Tốc độ của một phản ứng hóa học
a. là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
b. được kí hiệu là n và có đơn vị là mol/L.
c. phụ thuộc vào nồng độ, áp suất, diện tích bề mặt, nhiệt độ và chất xúc tác.
d. Nếu tính theo định luật tác dụng khối lượng là tốc độ tức thời của một phản ứng tại một thời điểm
Trong nhóm halogen thì
a) các halogen tồn tại ở dạng nguyên tử ở nhiệt độ phòng.
b) các halogen tồn tại ở dạng đơn chất trong tự nhiên.
c) các halogen không độc, không màu, không tan trong nước.
d) nguyên tố đầu tiên trong nhóm halogen là chất khí ở nhiệt độ phòng.
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình
“S (s) + O 2 (g) → SO 2 (g)” và tỏa ra một lượng nhiệt là 296,9kJ. Cho các phát biểu sau:
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
Khi nói về chlorine và hợp chất của chlorine thì
a) nước Javel có khả năng tẩy màu và sát khuẩn.
b ) cho giấy quì tím vào dung dịch nước chlorine quì tím chuyển màu hồng sau đó lại mất màu.
c) trong phản ứng của HCl với MnO 2 thì HCl đóng vai trò là chất bị khử.
d) trong công nghiệp, Cl 2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
Lời giải và đáp án
Halogen nào là nguyên tố phi kim mạnh nhất trong bảng tuần hoàn?
-
A.
Chlorine.
-
B.
Bromine.
-
C.
Iodine.
-
D.
Fluorine.
Đáp án : D
Dựa vào xu hướng biến đổi tính phi kim trong cùng một nhóm
Trong cùng một nhóm, tính kim loại tăng dần, tính phi kim giảm dần
Trong nhóm halogen, nguyên tố fluorine là phi kim mạnh nhất
Đáp án D
Cho phản ứng hóa học sau: Cu + HNO 3 → Cu(NO 3 ) 2 + NO + H 2 O. Sau khi đã cân bằng, tỉ lệ hệ số phân tử bị khử và số phân tử bị oxi hóa là
-
A.
3:8
-
B.
2:3
-
C.
8:3
-
D.
3:2
Đáp án : B
Dựa vào phương pháp bảo toàn electron
\(\begin{array}{l}C{u^o} \to C{u^{ + 2}} + 2{\rm{e|x3}}\\{N^{ + 5}} + 3e \to {N^{ + 2}}|x2\end{array}\)
3Cu + 8HNO 3 \( \to \)3Cu(NO 3 ) 2 + 2NO + 4H 2 O
Tỉ lệ hệ số phân tử bị khử và số phân tử bị oxi hóa là: 2:3
Đáp án B
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + 1/2O 2(g) → CO 2(g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Biết nhiệt tạo thành chuẩn của CO 2 là -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
-
A.
+221,0 kJ.
-
B.
-221,0 kJ.
-
C.
+110,5 kJ.
-
D.
–110,5 kJ.
Đáp án : D
Dựa vào công thức tính biến thiên enthalpy của phản ứng
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CO) = - 283,0\\ \to {\Delta _f}H_{298}^o(CO) = {\Delta _f}H_{298}^o(C{O_2}) + 283 = - 393,5 + 283 = - 110,5kJ\end{array}\)
Đáp án D
Cho các yếu tố: nhiệt độ, áp suất, diện tích bề mặt tiếp xúc, chất xúc tác, nồng độ. Có bao nhiêu yếu tố có thể ảnh hưởng đến tốc độ của phản ứng?
-
A.
5
-
B.
3
-
C.
2
-
D.
4
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Có 5 yếu tố ảnh hưởng đến tốc độ phản ứng
Đáp án A
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
-
A.
Nhận thêm 1 electron.
-
B.
Nhường đi 1 electron.
-
C.
Nhận thêm 2 electron.
-
D.
Nhường đi 7 electron.
Đáp án : A
Dựa vào cấu hình electron lớp ngoài của nguyên tố halogen
Các nguyên tố halogen có 7 electron lớp ngoài cùng nên có xu hướng nhận thêm 1 electron
Đáp án A
Cho phản ứng hóa học: Fe + CuSO 4 → FeSO 4 + Cu. Trong phản ứng trên xảy ra
-
A.
sự khử Fe 2+ và sự oxi hóa Cu.
-
B.
sự khử Fe 2+ và sự khử Cu 2+ .
-
C.
sự oxi hóa Fe và sự oxi hóa Cu.
-
D.
sự oxi hóa Fe và sự khử Cu 2+ .
Đáp án : D
Dựa vào quá trình cho nhận electron
Trong phản ứng trên xảy ra sự oxi hóa Fe và sự khử Cu 2+
Đáp án D
Trong phòng thí nghiệm người ta thường điều chế chlorine bằng cách nào sau đây?
-
A.
Cho HCl đặc tác dụng với MnO 2 , KMnO 4 …
-
B.
Phân hủy khí HCl.
-
C.
Điện phân dung dịch NaCl có màng ngăn.
-
D.
Điện phân nóng chảy NaCl.
Đáp án : A
Dựa vào phương pháp điều chế chlorine trong phòng thí nghiệm
Trong phòng thí nghiệm, người ta điều chế chlorine bằng cách cho HCl đặc tác dụng với MnO 2 , KMnO 4 ,…
Đáp án A
-
A.
Thí nghiệm bên trái có kết tủa xuất hiện trước.
-
B.
Thí nghiệm bên phải có kết tủa xuất hiện trước.
-
C.
Kết tủa xuất hiện đồng thời.
-
D.
Không có kết tủa xuất hiện.
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
ở thí nghiệm bến trái có xuất hiện kết tủa trước vì có nồng độ Na 2 S 2 O 3 lớn hơn
Đáp án A
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
-
A.
\(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)
-
B.
\(2A{l_{(s)}} + \frac{3}{2}{O_{2\,(g)}} \to A{l_2}{O_3}_{(s)}\,\,{\Delta _r}H_{298}^0 = - 1675,7\,kJ.\)
-
C.
\({C_2}{H_{4\,(g)}} + {H_{2\,(g)}} \to {C_2}{H_6}_{(g)}\,\,\,{\Delta _r}H_{298}^0 = - 137,0\,kJ.\)
-
D.
\({C_{(s)}} + {O_{2\,(g)}} \to C{O_{2\,(g)}}\,\,\,{\Delta _r}H_{298}^0 = - 393,5\,kJ.\)
Đáp án : A
Dựa vào dấu của biến thiên enthalpy
Phương trình nhiệt hóa học \(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)là phản ứng thu nhiệt vì có \({\Delta _r}H_{298}^o\)> 0
Đáp án A
Chất nào đây được dùng để diệt trùng nước sinh hoạt?
-
A.
Chlorine.
-
B.
Bromine.
-
C.
Oxygen.
-
D.
Nitrogen.
Đáp án : A
Dựa vào tính chất hóa học của các nguyên tố
Chlorine dùng để diệt trùng nước sinh hoạt
Đáp án A
Khi được bảo quản trong tủ lạnh, thức ăn chậm bị ôi, thiu. Yếu tố ảnh hưởng đến quá trình phản ứng được vận dụng trong ví dụ trên là
-
A.
Nhiệt độ.
-
B.
Nồng độ.
-
C.
Áp suất.
-
D.
Diện tích bề mặt.
Đáp án : A
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Khi được bảo quản trong tủ lạnh, thức ăn chậm bị ôi, thiu, yếu tố nhiệt độ được vận dụng để làm chậm quá trình ôi thiu của thức ăn
Đáp án A
Trong dãy 4 dung dịch HF; HCl; HBr; HI. Ta thấy
-
A.
tính acid giảm dần từ trái sang phải.
-
B.
tính acid tăng dần từ trái sang phải.
-
C.
tính acid biến đổi không theo qui luật.
-
D.
tính acid không biến đổi.
Đáp án : B
Dựa vào xu hướng biến đổi dung dịch acid HX
Tính acid tăng dần từ trái sang phải
Đáp án B
Tốc độ phản ứng tại một thời điểm của phản ứng đơn giản 2A + B → C được tính bằng biểu thức: \(v = k.C_A^2.C_B^{}\). Hằng số tốc độ k phụ thuộc vào yếu tố nào trong các yếu tố sau?
-
A.
Nhiệt độ của phản ứng.
-
B.
Thời gian xảy ra phản ứng.
-
C.
Nồng độ của chất sản phẩm.
-
D.
Nồng độ của chất phản ứng.
Đáp án : A
Hằng số tốc độ k phụ thuộc vào nhiệt độ của phản ứng
Đáp án A
Cho các phản ứng sau:
(a) 4HCl + PbO 2 → PbCl 2 + Cl 2 + 2H 2 O (b) HCl + NH 4 HCO 3 → NH 4 Cl + CO 2 + H 2 O
(c) 2HCl + 2HNO 3 → 2NO 2 + Cl 2 + 2H 2 O (d) 2HCl + Fe → FeCl 2 + H 2
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
-
A.
3
-
B.
4
-
C.
1
-
D.
2
Đáp án : C
HCl thể hiện tính oxi hóa khi giảm số oxi hóa
(d) HCl thể hiện tính oxi hóa
Đáp án C
Một phản ứng có hệ số nhiệt độ Van’t Hoff là γ = 3. Khi nhiệt độ tăng 10 o C, tốc độ của phản ứng trên sẽ
-
A.
tăng 3 lần.
-
B.
tăng 9 lần
-
C.
giảm 9 lần.
-
D.
giảm 3 lần.
Đáp án : A
Dựa vào công thức tính hệ số nhiệt độ Van’t Hoff.
\(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{(VT - 10)}}{{10}}}} = {3^1}\)
Tốc độ phản ứng tăng 3 lần
Đáp án A
Tính chất hóa học đặc trưng của các đơn chất halogen là
-
A.
tính oxi hóa.
-
B.
tính khử.
-
C.
tính acid.
-
D.
tính base.
Đáp án : A
Dựa vào tính chất hóa học của đơn chất halogen
Đơn chất halogen thể hiện tính oxi hóa
Đáp án A
Cho các phát biểu sau:
(1) Dung dịch HF là acid yếu và không được chứa trong lọ thuỷ tinh.
(2) Trong tự nhiên chlorine chủ yếu tồn tại ở dạng đơn chất.
(3) Dung dịch NaF loãng dùng làm thuốc chống sâu răn
(4) Đi từ F 2 tới I 2 nhiệt độ sôi tăng dần, nhiệt độ nóng chảy tăng dần, màu sắc đậm dần.
(5) Có thể điều chế Cl 2 bằng phản ứng đun nóng HCl đặc với KMnO 4 .
Số phát biểu đúng là
-
A.
5
-
B.
2
-
C.
3
-
D.
4
Đáp án : D
Dựa vào kiến thức về nguyên tố halogen
(1) đúng
(2) sai, chlorine tồn tại dạng hợp chất
(3) đúng
(4) đúng
(5) đúng
Đáp án D
Hóa chất nào sau đây thường dùng để nhận biết I 2 ?
-
A.
Phenolphtalein .
-
B.
Hồ tinh bột .
-
C.
Quỳ tím.
-
D.
Nước vôi trong .
Đáp án : B
Có thể dùng hồ tinh bột để nhận biết I 2
Tốc độ của một phản ứng hóa học
a. là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
b. được kí hiệu là n và có đơn vị là mol/L.
c. phụ thuộc vào nồng độ, áp suất, diện tích bề mặt, nhiệt độ và chất xúc tác.
d. Nếu tính theo định luật tác dụng khối lượng là tốc độ tức thời của một phản ứng tại một thời điểm
a. là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
b. được kí hiệu là n và có đơn vị là mol/L.
c. phụ thuộc vào nồng độ, áp suất, diện tích bề mặt, nhiệt độ và chất xúc tác.
d. Nếu tính theo định luật tác dụng khối lượng là tốc độ tức thời của một phản ứng tại một thời điểm
a) đúng
b) sai, đơn vị của tốc độ phản ứng phụ thuộc vào đơn vị của nồng độ và thời gian
c) sai, tốc độ phản ứng không phụ thuộc vào nồng độ, áp suất, diện tích bề mặt, nhiệt độ và chất xúc tác.
d) đúng
Trong nhóm halogen thì
a) các halogen tồn tại ở dạng nguyên tử ở nhiệt độ phòng.
b) các halogen tồn tại ở dạng đơn chất trong tự nhiên.
c) các halogen không độc, không màu, không tan trong nước.
d) nguyên tố đầu tiên trong nhóm halogen là chất khí ở nhiệt độ phòng.
a) các halogen tồn tại ở dạng nguyên tử ở nhiệt độ phòng.
b) các halogen tồn tại ở dạng đơn chất trong tự nhiên.
c) các halogen không độc, không màu, không tan trong nước.
d) nguyên tố đầu tiên trong nhóm halogen là chất khí ở nhiệt độ phòng.
a) sai, các halogen tồn tại ở dạng phân tử
b) sai, các halogen tồn tại ở dạng hợp chất trong tự nhiên
c) sai, chlorine độc
d) đúng
Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình
“S (s) + O 2 (g) → SO 2 (g)” và tỏa ra một lượng nhiệt là 296,9kJ. Cho các phát biểu sau:
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ mol -1
b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ.
c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
a) sai, biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ
b) đúng
c) đúng
d) đúng
Khi nói về chlorine và hợp chất của chlorine thì
a) nước Javel có khả năng tẩy màu và sát khuẩn.
b ) cho giấy quì tím vào dung dịch nước chlorine quì tím chuyển màu hồng sau đó lại mất màu.
c) trong phản ứng của HCl với MnO 2 thì HCl đóng vai trò là chất bị khử.
d) trong công nghiệp, Cl 2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
a) nước Javel có khả năng tẩy màu và sát khuẩn.
b ) cho giấy quì tím vào dung dịch nước chlorine quì tím chuyển màu hồng sau đó lại mất màu.
c) trong phản ứng của HCl với MnO 2 thì HCl đóng vai trò là chất bị khử.
d) trong công nghiệp, Cl 2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
a) đúng
b) sai, quỳ tím chuyển sang màu đỏ và không mất màu
c) đúng
d) đúng
\(\bar v = \frac{{\Delta C}}{t} = \frac{1}{2}.\frac{{0,3033 - 0,2330}}{{120}} = 2,{92.10^{ - 4}}(M/s)\)
n FeCl3 = \(\frac{{16,25}}{{162,5}} = 0,1mol\)
2KMnO 4 + 16HCl \( \to \)2KCl + 2MnCl 2 + 5Cl 2 + 8H 2 O
0,06 0,15
3Cl 2 + 2Fe \( \to \) 2FeCl 3
0,15 0,1
m KMnO4 = 0,06 . 158 = 9,48g
\(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{(T2 - T1)}}{{10}}}} = {3^{\frac{{(60 - 20)}}{{10}}}} = {3^4} = 81\)lần
MgO và MgCO 3 tác dụng với HCl tạo ra khí => khí đó là CO 2
n CO2 = 7,437 : 24,79 = 0,3 mol => n CO2 = n MgCO3 = 0,3 mol
m muối = m MgCl2 => n MgCl2 = 38: 95 = 0,4 mol = n MgO + n MgCO3
=> n MgO = 0,4 – 0,3 = 0,1 mol
%m MgO = \(\frac{{0,1.40}}{{0,1.40 + 0,3.84}}.100 = 13,7\% \)