Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 8
Xét phản ứng đốt cháy methane:
Đề bài
Xét phản ứng đốt cháy methane:
CH 4 (g) + 2O 2 (g) ⟶ CO 2 (g) + 2H 2 O( l ) \({\Delta _r}H_{298}^o\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO 2 (g) và H 2 O( l ) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
– 74,8 kJ.
-
B.
74,8 kJ.
-
C.
– 211,6 kJ.
-
D.
211,6 kJ.
Cho phản ứng sau:
CH 4 ( g ) + Cl 2 ( g ) → CH 3 Cl( g ) + HCl( g )
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
-
A.
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{H_4}) + {\Delta _f}H_{298}^o(C{l_2}) - {\Delta _f}H_{298}^o(C{H_3}Cl) - {\Delta _f}H_{298}^o(HCl)\)
-
B.
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{H_3}Cl) + {\Delta _f}H_{298}^o(HCl) - {\Delta _f}H_{298}^o(C{H_4}) - {\Delta _f}H_{298}^o(C{l_2})\)
-
C.
\({\Delta _r}H_{298}^o\)= E b (CH 4 ) + E b (Cl 2 ) – E b (CH 3 Cl) – E b (HCl)
-
D.
\({\Delta _r}H_{298}^o\)= E b (CH 3 Cl) + E b (HCl) – E b (CH4) – E b (Cl 2 )
Tốc độ trung bình của phản ứng là
-
A.
Tốc độ trung bình của phản ứng là
-
B.
tốc độ được tính trong một khoảng thời gian phản ứng.
-
C.
biến thiên nồng độ của phản ứng.
-
D.
biến thiên nồng độ của phản ứng.
Cho phản ứng hoá học:
Zn( s ) + 2HCl( aq ) → ZnCl 2 ( aq ) + H 2 ( g )
Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
-
A.
1,5 × 10 -3 M/s.
-
B.
1,0 × 10 -3 M/s.
-
C.
2,5 × 10 -3 M/s.
-
D.
2,0 × 10 -3 M/s.
Phát biểu nào sau đây không đúng?
-
A.
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
-
B.
Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
-
C.
Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
-
D.
Tốc độ phản ứng đốt cháy cồn (alcohol) lớn hơn tốc độ của phản ứng gỉ sắt.
Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là
-
A.
áp suất.
-
B.
nhiệt độ.
-
C.
nồng độ.
-
D.
chất xúc tác.
Khi nhiệt độ tăng thêm 10 o C, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70 o C xuống 40 o C?
-
A.
8
-
B.
16
-
C.
32
-
D.
64
Các enzyme là chất xúc tác, có chức năng:
-
A.
Giảm năng lượng hoạt hóa của phản ứng.
-
B.
Tăng năng lượng hoạt hóa của phản ứng.
-
C.
Tăng nhiệt độ của phản ứng.
-
D.
Giảm nhiệt độ của phản ứng.
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Vị trí nhóm halogen trong bảng tuần hoàn là
-
A.
Nhóm VA.
-
B.
Nhóm VIA.
-
C.
Nhóm VIIA.
-
D.
Nhóm IVA.
Nguyên tử chlorine không có khả năng thể hiện số oxi hoá
-
A.
+3
-
B.
0
-
C.
+1
-
D.
+2
Chất nào dưới đây có sự thăng hoa khi đun nóng?
-
A.
Cl 2 .
-
B.
I 2 .
-
C.
Br 2 .
-
D.
F 2 .
Cho phản ứng tổng quát sau:
X 2 ( g ) + 2KBr( aq ) → 2KX( aq ) + Br 2 ( aq )
X có thể là chất nào sau đây?
-
A.
Cl 2 .
-
B.
I 2 .
-
C.
F 2 .
-
D.
O 2 .
Chọn phương trình phản ứng đúng?
-
A.
Fe + 2HCl → FeCl 2 + H 2 .
-
B.
2Fe + 6HCl → 2FeCl 3 + 3H 2 .
-
C.
3Fe + 8HCl → FeCl 2 + 2FeCl 3 + 4H 2 .
-
D.
Cu + 2HCl → CuCl 2 + H 2 .
Liên kết trong hợp chất hydrogen halide là
-
A.
liên kết cộng hóa trị không phân cực.
-
B.
liên kết cho – nhận
-
C.
liên kết ion.
-
D.
liên kết cộng hóa trị phân cực.
Phản ứng giữa chất nào sau đây với dung dịch H 2 SO 4 đặc, nóng không phải là phản ứng oxi hóa – khử?
-
A.
NaBr.
-
B.
KI.
-
C.
NaCl.
-
D.
NaI.
Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là
-
A.
Na 2 CO 3 .
-
B.
AgCl.
-
C.
AgNO 3 .
-
D.
NaOH.
Cho các phát biểu sau:
a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Cho các phát biểu sau
a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Cho các phát biểu sau
a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ
\({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1)
a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Lời giải và đáp án
Xét phản ứng đốt cháy methane:
CH 4 (g) + 2O 2 (g) ⟶ CO 2 (g) + 2H 2 O( l ) \({\Delta _r}H_{298}^o\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO 2 (g) và H 2 O( l ) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
– 74,8 kJ.
-
B.
74,8 kJ.
-
C.
– 211,6 kJ.
-
D.
211,6 kJ.
Đáp án : A
Dựa vào công thức tính \({\Delta _r}H_{298}^o\)
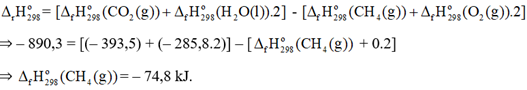
Cho phản ứng sau:
CH 4 ( g ) + Cl 2 ( g ) → CH 3 Cl( g ) + HCl( g )
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
-
A.
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{H_4}) + {\Delta _f}H_{298}^o(C{l_2}) - {\Delta _f}H_{298}^o(C{H_3}Cl) - {\Delta _f}H_{298}^o(HCl)\)
-
B.
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{H_3}Cl) + {\Delta _f}H_{298}^o(HCl) - {\Delta _f}H_{298}^o(C{H_4}) - {\Delta _f}H_{298}^o(C{l_2})\)
-
C.
\({\Delta _r}H_{298}^o\)= E b (CH 4 ) + E b (Cl 2 ) – E b (CH 3 Cl) – E b (HCl)
-
D.
\({\Delta _r}H_{298}^o\)= E b (CH 3 Cl) + E b (HCl) – E b (CH4) – E b (Cl 2 )
Đáp án : C
Dựa vào công thức tính \({\Delta _r}H_{298}^o\)theo năng lượng liên kết
\({\Delta _r}H_{298}^o\)= E b (CH 4 ) + E b (Cl 2 ) – E b (CH 3 Cl) – E b (HCl)
Đáp án C
Tốc độ trung bình của phản ứng là
-
A.
Tốc độ trung bình của phản ứng là
-
B.
tốc độ được tính trong một khoảng thời gian phản ứng.
-
C.
biến thiên nồng độ của phản ứng.
-
D.
biến thiên nồng độ của phản ứng.
Đáp án : B
Dựa vào khái niệm của tốc độ phản ứng
Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng
Đáp án B
Cho phản ứng hoá học:
Zn( s ) + 2HCl( aq ) → ZnCl 2 ( aq ) + H 2 ( g )
Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
-
A.
1,5 × 10 -3 M/s.
-
B.
1,0 × 10 -3 M/s.
-
C.
2,5 × 10 -3 M/s.
-
D.
2,0 × 10 -3 M/s.
Đáp án : C
Dựa vào công thức tính tốc độ phản ứng
\(v = \frac{1}{2}.\frac{{0,6 - 0,4}}{{40}} = 0,0025M/s\)
Đáp án C
Phát biểu nào sau đây không đúng?
-
A.
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
-
B.
Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
-
C.
Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
-
D.
Tốc độ phản ứng đốt cháy cồn (alcohol) lớn hơn tốc độ của phản ứng gỉ sắt.
Đáp án : B
Dựa vào kiến thức về tốc độ phản ứng
Tốc độ phản ứng luôn dương
Đáp án B
Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là
-
A.
áp suất.
-
B.
nhiệt độ.
-
C.
nồng độ.
-
D.
chất xúc tác.
Đáp án : C
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Dùng bình chứa oxygen làm tăng nồng độ oxygen để đốt cháy acetylene
Đáp án C
Khi nhiệt độ tăng thêm 10 o C, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70 o C xuống 40 o C?
-
A.
8
-
B.
16
-
C.
32
-
D.
64
Đáp án : A
Dựa vào hệ số nhiệt độ Van’t Hoff
\(\frac{{{v_{{{70}^o}C}}}}{{{v_{{{40}^o}C}}}} = {\gamma ^{\frac{{(70 - 40)}}{{10}}}} = {2^3} = 8\)
Khi giảm nhiệt độ xuống tốc độ phản ứng giảm 8 lần
Đáp án A
Các enzyme là chất xúc tác, có chức năng:
-
A.
Giảm năng lượng hoạt hóa của phản ứng.
-
B.
Tăng năng lượng hoạt hóa của phản ứng.
-
C.
Tăng nhiệt độ của phản ứng.
-
D.
Giảm nhiệt độ của phản ứng.
Đáp án : A
Dựa vào khái niệm về chất xúc tác
Các enzyme là chất xúc tác có chức năng làm giảm năng lượng hoạt hóa của phản ứng
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : B
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
(1), (2), (4) là các biện pháp làm tăng tốc độ phản ứng
Đáp án B
Vị trí nhóm halogen trong bảng tuần hoàn là
-
A.
Nhóm VA.
-
B.
Nhóm VIA.
-
C.
Nhóm VIIA.
-
D.
Nhóm IVA.
Đáp án : C
Nhóm Halogen nằm ở nhóm VIIA trong bảng tuần hoàn
Đáp án C
Nguyên tử chlorine không có khả năng thể hiện số oxi hoá
-
A.
+3
-
B.
0
-
C.
+1
-
D.
+2
Đáp án : D
Dựa vào số oxi hóa của nguyên tử chlorine
Nguyên tử chlorine không thể hiện số oxi hóa +2
Đáp án D
Chất nào dưới đây có sự thăng hoa khi đun nóng?
-
A.
Cl 2 .
-
B.
I 2 .
-
C.
Br 2 .
-
D.
F 2 .
Đáp án : B
Dựa vào trạng thái của nguyên tố halogen
I 2 có sự thăng hoa khi đun nóng
Đáp án B
Cho phản ứng tổng quát sau:
X 2 ( g ) + 2KBr( aq ) → 2KX( aq ) + Br 2 ( aq )
X có thể là chất nào sau đây?
-
A.
Cl 2 .
-
B.
I 2 .
-
C.
F 2 .
-
D.
O 2 .
Đáp án : A
Dựa vào khả năng tham gia phản ứng khử của nguyên tử halogen
X 2 là Cl 2 vì tính khử của Cl 2 mạnh hơn Br -
Đáp án A
Chọn phương trình phản ứng đúng?
-
A.
Fe + 2HCl → FeCl 2 + H 2 .
-
B.
2Fe + 6HCl → 2FeCl 3 + 3H 2 .
-
C.
3Fe + 8HCl → FeCl 2 + 2FeCl 3 + 4H 2 .
-
D.
Cu + 2HCl → CuCl 2 + H 2 .
Đáp án : A
Dựa vào tính chất của acid HCl
Fe + 2HCl → FeCl 2 + H 2 đúng
Đáp án A
Liên kết trong hợp chất hydrogen halide là
-
A.
liên kết cộng hóa trị không phân cực.
-
B.
liên kết cho – nhận
-
C.
liên kết ion.
-
D.
liên kết cộng hóa trị phân cực.
Đáp án : D
Dựa vào độ âm điện của halogen với hydrogen
Liên kết trong hợp chất hydrogen halide là liên kết cộng hóa trị phân cực
Đáp án D
Phản ứng giữa chất nào sau đây với dung dịch H 2 SO 4 đặc, nóng không phải là phản ứng oxi hóa – khử?
-
A.
NaBr.
-
B.
KI.
-
C.
NaCl.
-
D.
NaI.
Đáp án : C
H 2 SO 4 đặc nóng thể hiện tính oxi hóa mạnh khi tác dụng với chất khử sẽ tạo nên phản ứng oxi hóa khử
NaCl khi phản ứng với H 2 SO 4 đặc nóng không thay đổi số oxi hóa
Đáp án C
Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là
-
A.
Na 2 CO 3 .
-
B.
AgCl.
-
C.
AgNO 3 .
-
D.
NaOH.
Đáp án : C
Dựa vào màu sắc của kết tủa gốc ion I - và Cl -
AgNO 3 là thuốc thử để phân biệt NaI và KCl vì AgI có màu vàng đậm, AgCl có màu trắng
Cho các phát biểu sau:
a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
a) đúng
b) sai, F 2 được sản xuất từ điện phân dung dịch KF, HF
c) sai, HCl được dùng để tẩy rửa các oxide của sắt trên bề mặt của thép
d) đúng
Cho các phát biểu sau
a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
a) đúng
b) đúng
c) sai, AgF tan trong nước
d) đúng
Cho các phát biểu sau
a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
a) sai, các phản ứng đơn giản tuân theo định luật tác dụng khối lượng
b) sai, Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
c) sai, hằng số tốc độ phản ứng phụ thuộc vào nhiệt độ và bản chất của chất tham gia
d) đúng
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ
\({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1)
a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
(a) sai, vì phản ứng tạo 2 mol HCl
(b) đúng
(c) đúng
(d) sai
2NaCl ( tt) + H 2 SO 4 đ \( \to \) Na 2 SO 4 + 2 HCl
4 HCl + MnO 2 \( \to \)MnCl 2 + Cl 2 + H 2 O
Cl 2 + 2KBr \( \to \) 2KCl + Br 2
Br 2 + 2 KI \( \to \) 2KBr + I 2
n Cl2 = 9,916/24,79 = 0,4 mol
MnO 2 +4HCl đặc \( \to \)MnCl 2 +Cl 2 +2H 2 O
0,4 \( \to \) 0,4 (mol)
MnO 2 : chất oxi hóa ; HCl : chất khử
m MnO 2 = 0,4 x 87 = 34,8gam
n B =\(\frac{{0,4958}}{{24,79}}\) = 0,02 mol
Gọi số mol MgCO 3 là x (mol), số mol Zn là y (mol).
Phương trình hoá học:
MgCO 3 + 2HCl → MgCl 2 + CO 2 + H 2 O
x 2x x x mol
Zn + 2HCl → ZnCl 2 + H 2
y 2y y y mol
Ta có hệ phương trình:
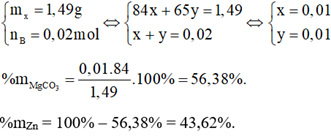
a) \({v_1} = \frac{{\Delta C}}{{{t_1}}};{\rm{ }}{v_2} = \frac{{\Delta C}}{{{t_2}}}{\rm{ }} \to {\rm{ }}\frac{{{v_2}}}{{{v_1}}} = \frac{{{t_1}}}{{{t_2}}}\)
\(\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}{\rm{ }} \Leftrightarrow {\rm{ }}\frac{{3,8}}{{3,2}} = {\gamma ^{\frac{{100 - 90}}{{10}}}}{\rm{ }} \to {\rm{ }}\gamma = 1,1875\)
b) \(\frac{{{v_{90}}}}{{{v_{80}}}} = \frac{{{t_{80}}}}{{{t_{90}}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}{\rm{ }} \Leftrightarrow {\rm{ }}\frac{{{t_{80}}}}{{3,8}} = 1,{1875^{\frac{{90 - 80}}{{10}}}}{\rm{ }} \to {\rm{ }}{t_{80}} = {\rm{ 4,5 min}}\)