Bài 12: Alkane trang 72, 73, 74, 75, 76, 77, 78, 79, 80 Hóa học 11 Cánh diều
Viết công thức cấu tạo dạng đầy đủ của các hydrocarbon có công thức phân tử CH4, C2H6 và C3H8. Dự đoán tính chất của các chất dựa trên đặc điểm liên kết của chúng.
CH tr 72 MĐ
Viết công thức cấu tạo dạng đầy đủ của các hydrocarbon có công thức phân tử CH 4 , C 2 H 6 và C 3 H 8 . Dự đoán tính chất của các chất dựa trên đặc điểm liên kết của chúng.
Phương pháp giải:
- Công thức cấu tạo biểu diễn tất cả các nguyên tử và liên kết trong phân tử được gọi là công thức cấu tạo đầy đủ.
- Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử. Liên kết cộng hóa trị thường gặp giữa phi kim với phi kim.
Lời giải chi tiết:
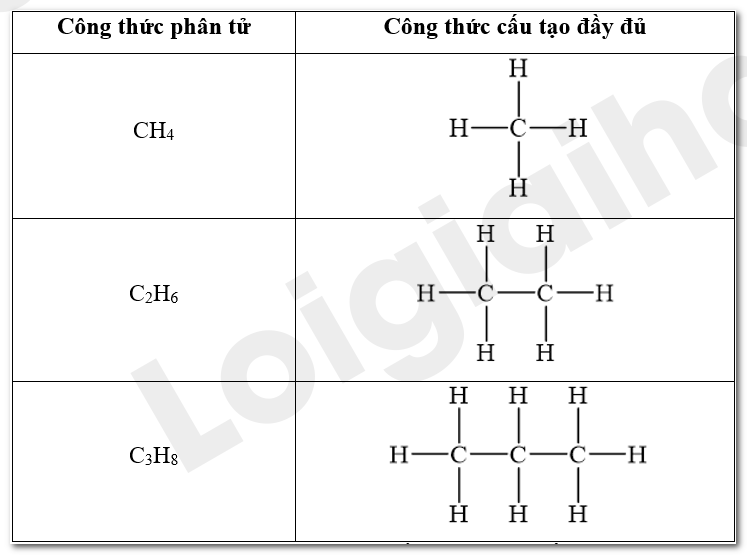
Trong phân tử alkane chỉ có các liên kết \(\sigma \) bền và kém phân cực. Mỗi nguyên tử carbon cũng như hydrogen đã tạo ra số liên kết cộng hoá trị lớn nhất của chúng. Vì thế, các alkane khó tham gia vào các phản ứng hoá học và phản ứng xảy ra sẽ kèm theo việc thay thế nguyên tử hydrogen hoặc bẻ gãy mạch carbon. Các phản ứng tiêu biểu của alkane là phản ứng thế halogen (chlorine, bromine), phản ứng cracking, reforming và phản ứng cháy.
CH tr 73 CH
Mô tả hình dạng của phân tử methane và ethane.
Phương pháp giải:

Lời giải chi tiết:
- Trong phân tử methane, bốn liên kết C – H giống nhau tạo với nhau 1 góc 109,5 o và hướng về 4 đỉnh của hình tứ diện đều.
- Trong phân tử ethane, mỗi nguyên tử C nằm ở tâm của một tứ diện mà bốn đỉnh là các nguyên tử hydrogen và carbon, các góc liên kết khoảng 109,5 o .
CH tr 74 CH
Gọi tên các hợp chất isobutane, isopentane và neopentane theo danh pháp thay thế
Phương pháp giải:
Tên alkane = Vị trí nhóm thế alkane – tên của nhóm thế alkane + tên alkane mạch chính.
Lời giải chi tiết:
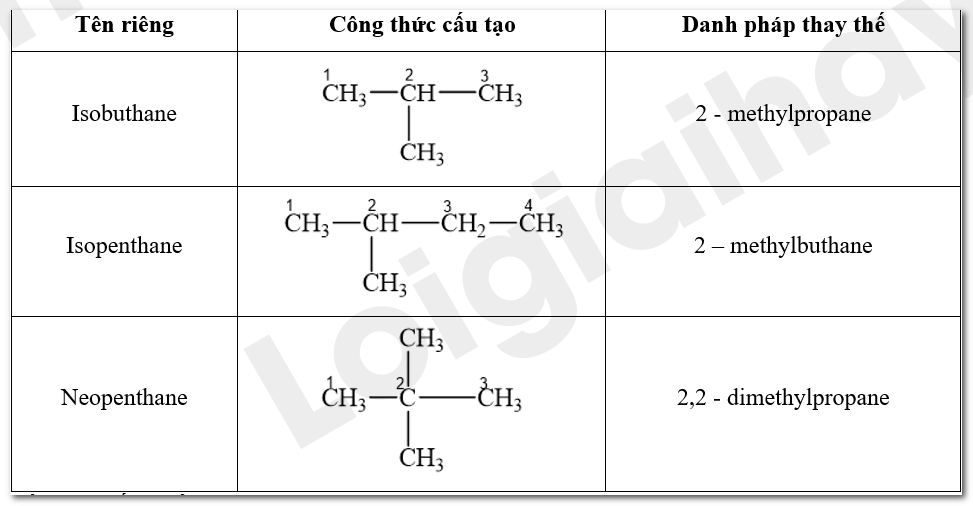
CH tr 76 TN 1
Thí nghiệm 1. Phản ứng của hexane với bromine
Chuẩn bị: Hexane, nước bromine; ống nghiệm, cốc nước nóng và bông tẩm dung dịch NaOH.
Tiến hành: Cho vào ống nghiệm khô khoảng 1 mL hexane và nhỏ thêm vào ống nghiệm khoảng 1 mL nước bromine. Lắc nhẹ hỗn hợp phản ứng. Nút ống nghiệm bằng bông đã tẩm dung dịch NaOH rồi nhúng ống nghiệm vào trong cốc nước nóng 50 °C (đã chuẩn bị trước) hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời.
Yêu cầu: Quan sát, nhận xét màu sắc và tính đồng nhất của hỗn hợp phản ứng trước và sau khi đun nóng (hoặc để ra ngoài ánh nắng Mặt Trời).
Phương pháp giải:
Trong điều kiện thích hợp (được chiếu sáng hoặc đun nóng), alkane có thể phản ứng với halogen (chlorine, bromine). Khi đó, các nguyên tử hydrogen trong phân tử alkane dần bị thay thế bởi các nguyên tử halogen. Phản ứng xảy ra theo từng nấc để tạo thành lần lượt các dẫn xuất monohalogeno (chứa một nguyên tử halogen), dihalogeno (chứa hai nguyên tử halogen), trihalogeno (chứa ba nguyên tür halogen)....
Lời giải chi tiết:
Ống nghiệm chứa hexane và nước bromine có màu vàng nhạt, dung dịch phân thành hai lớp, lớp màu vàng chứa hexane và bromine ở dưới ống nghiệm, lớp không màu chứa nước ở trên.
Sau khi nhúng ống nghiệm vào cốc nước nóng (hoặc để ống nghiệm ra nơi có ánh sáng Mặt Trời), màu vàng nhạt dần rồi mất màu, dung dịch trong ống nghiệm tách lớp.
CH tr 76 TN 2
Thí nghiệm 2. Tác dụng của potassium permanganate với hexane
Chuẩn bị: Hexane, dung dịch KMnO, 1%; ống nghiệm.
Tiến hành: Cho vào ống nghiệm khoảng 1 mL hexane, thêm tiếp vào ống nghiệm vài giọt dung dịch thuốc tím (KMnO4) 1% và lắc đều.
Yêu cầu : Quan sát, nhận xét màu sắc và tính đồng nhất của hỗn hợp phản ứng.
Phương pháp giải:
Alkane không phản ứng oxi hóa với dung dịch thuốc tím KMnO 4 .
Lời giải chi tiết:
Dung dịch trong ống nghiệm tách thành hai lớp, lớp trên không màu là hexane, lớp dưới có màu tím là dung dịch thuốc tím.
CH tr 77 LT
Viết công thức cấu tạo các sản phẩm monobromo có thể tạo thành trong phản ứng giữa bromine và hexane ở Thí nghiệm 1.
Phương pháp giải:
Trong điều kiện thích hợp (được chiếu sáng hoặc đun nóng), alkane có thể phản ứng với halogen (chlorine, bromine). Khi đó, các nguyên tử hydrogen trong phân tử alkane dần bị thay thế bởi các nguyên tử halogen. Phản ứng xảy ra theo từng nấc để tạo thành lần lượt các dẫn xuất monohalogeno (chứa một nguyên tử halogen), dihalogeno (chứa hai nguyên tử halogen), trihalogeno (chứa ba nguyên tür halogen)....
Lời giải chi tiết:
Các sản phẩm monobromo có thể tạo thành trong phản ứng giữa bromine và hexane ở Thí nghiệm 1:
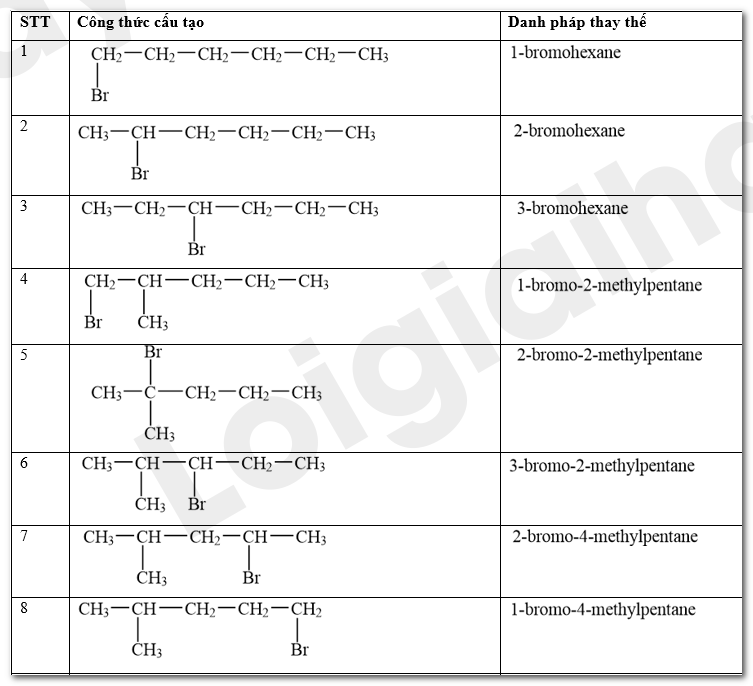
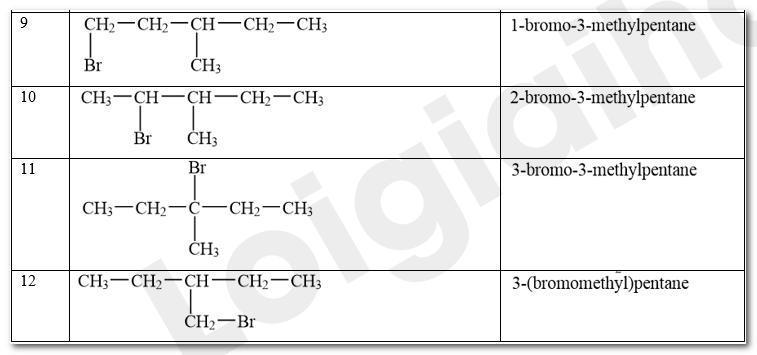
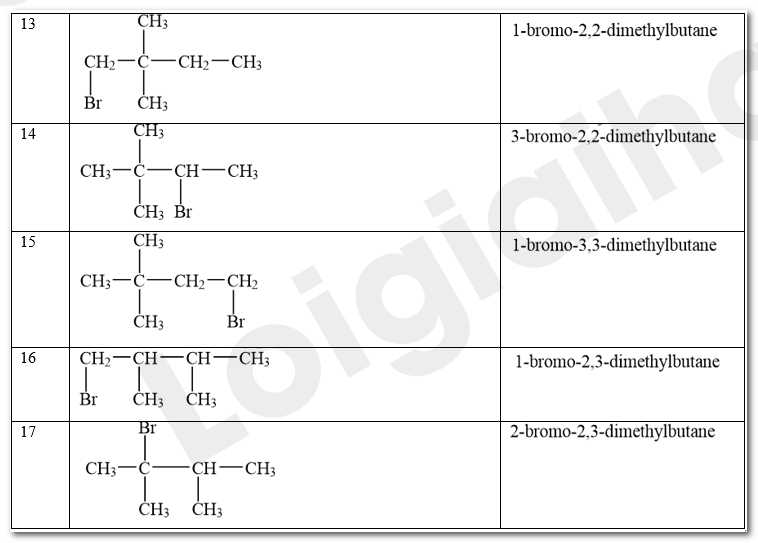
CH 78 TN 3
Thí nghiệm 3. Đốt cháy hexane
Chuẩn bị: Hexane; chén sứ, que đóm dài, diêm hoặc bật lửa.
Tiến hành: Cho khoảng 1 mL hexane vào chén sứ, dùng que đóm dài để châm lửa đốt hexane.
Yêu cầu: Quan sát, nhận xét màu ngọn lửa và viết phương trình hóa học của phản ứng oxi hoá hoàn toàn hexane.
Phương pháp giải:
Ở nhiệt độ cao, các alkane bị oxi hoá bởi oxygen. Có thể xảy ra phản ứng oxi hoá hoàn toàn (tạo thành carbon dioxide) hay phản ứng oxi hoá không hoàn toàn (tạo thành carbon monoxide hoặc carbon) tuỳ thuộc vào điều kiện của phản ứng.
Lời giải chi tiết:
Nhận xét: Đốt cháy hexane cho ngọn lửa màu vàng.
Phương trình:
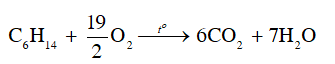
CH tr 78 CH
Biogas hay khí sinh học là một hỗn hợp khí (chủ yếu là methane, chiếm hơn 60%) được sinh ra từ quá trình phân huỷ kị khí của các phụ phẩm nông nghiệp (chất thải của gia súc, gia cầm, rơm, rạ,...), rác thải hữu cơ,... Mỗi mở biogas có thể cung cấp năng lượng tương đương với 0,4 kg dầu diesel hoặc 0,6 kg xăng hoặc 0,8 kg than. Cho biết sử dụng biogas mang lại lợi ích gì?
Phương pháp giải:
Ở nhiệt độ cao, các alkane bị oxi hoá bởi oxygen. Có thể xảy ra phản ứng oxi hoá hoàn toàn (tạo thành carbon dioxide) hay phản ứng oxi hoá không hoàn toàn (tạo thành carbon monoxide hoặc carbon) tuỳ thuộc vào điều kiện của phản ứng
Lời giải chi tiết:
Lợi ích khi sử dụng khí biogas:
+ Giảm thiểu khí thải và ô nhiễm.
+ Tái sử dụng phân bón hữu cơ, tạo ra phân bón hữu cơ giàu dinh dưỡng và giảm thiểu sự phụ thuộc vào phân bón hóa học.
+ Tiết kiệm chi phí năng lượng: sử dụng khí biogas thay cho các nguồn năng lượng hóa thạch sẽ giúp tiết kiệm chi phí năng lượng và giảm thiểu phát thải khí nhà kính.
+ Tạo ra các cơ hội kinh doanh bao gồm việc sản xuất và bán khí biogas, phân bón hữu cơ và các sản phẩm khác từ quá trình phân hủy sinh học.
CH tr 79 CH
Biện pháp nào sau đây không làm giảm ô nhiễm môi trường gây ra do sử dụng nhiên liệu từ dầu mỏ?
A. Đưa thêm hợp chất có chứa chì vào xăng để làm tăng chỉ số octane của xăng.
B. Đưa thêm chất xúc tác vào ống xả động cơ để chuyển hoá các khí thải độc.
C. Tăng cường sử dụng biogas.
D. Tổ chức thu gom và xử lí dầu cặn.
Phương pháp giải:
Xăng dầu có chỉ số octane càng cao thì càng có hiệu suất cháy cao, đồng thời giảm thiểu được ô nhiễm môi trường
Lời giải chi tiết:
Việc đưa chì vào xăng để tăng chỉ số octane không làm giảm ô nhiễm môi trường vì lượng chì trong xăng cao làm ô nhiễm không khí.
→ Chọn A .
CH tr 79 VD
Hãy đề xuất một số biện pháp góp phần làm giảm ô nhiễm môi trường do các phương tiện giao thông gây ra
Phương pháp giải:
Tăng hiệu suất đốt cháy và xử lý khí thải từ động cơ trước khi xả thải.
Lời giải chi tiết:
Biện pháp góp phần làm giảm ô nhiễm môi trường do các phương tiện giao thông gây ra:
+ Tăng hiệu suất đốt cháy nhiên liệu của động cơ, tăng chỉ số octane của xăng.
+ Sử dụng chất xúc tác vào ống xả của động cơ để khí thải độc hại được chuyển hoá thành carbon dioxide và nước.
+ Sử dụng nhiên liệu sạch như xăng E5.
+ Bảo dưỡng định kì cho phương tiện giao thông.
+ Sử dụng phương tiện giao thông công cộng, xe điện.
Bài tập Bài 1
Viết công thức cấu tạo và gọi tên thay thế của các hydrocarbon có công thức phân tử C 5 H 12 .
Phương pháp giải:
Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết đôi, liên kết ba) giữa các nguyên tử trong phân tử.
Tên alkane = Vị trí nhóm thế alkane – tên của nhóm thế alkane + tên alkane mạch chính.
Lời giải chi tiết:
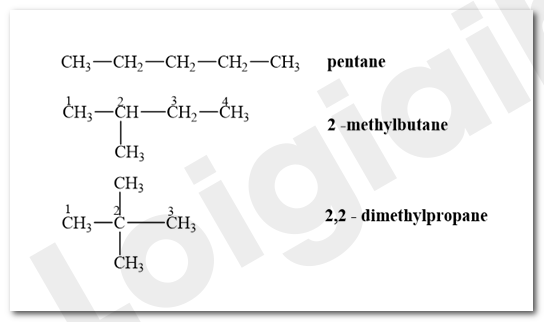
Bài tập Bài 2
Vì sao không được dùng nước để dập tắt đám cháy xăng, dầu mà phải dùng cát hoặc CO 2 ?
Phương pháp giải:
Ở nhiệt độ cao, các alkane bị oxi hoá bởi oxygen. Có thể xảy ra phản ứng oxi hoá hoàn toàn (tạo thành carbon dioxide) hay phản ứng oxi hoá không hoàn toàn (tạo thành carbon monoxide hoặc carbon) tuỳ thuộc vào điều kiện của phản ứng.
Lời giải chi tiết:
Xăng dầu nhẹ hơn nước và không tan trong nước, nếu ta dập đám cháy gây ra bởi xăng dầu bằng nước thì nước làm loang xăng dầu, nhiệt từ đám cháy làm nước bốc hơi, cháy và tăng áp suất khiến đám cháy còn lan rộng lớn và khó dập tắt hơn. Sử dụng cát hoặc CO 2 giúp ngăn cản xăng dầu cháy tiếp xúc với khí O 2 , làm đám cháy bị dập tắt. Do đó không được dùng nước để dập đám cháy gây ra do xăng dầu.
Bài tập Bài 3
Dầu thô có thành phần chính là các hydrocarbon. Người ta có thể phân tách các hydrocarbon có trong dầu thô bằng phương pháp chưng cất phân đoạn. Mỗi phân đoạn gồm một số hydrocarbon có nhiệt độ sôi gần nhau.
a) Vì sao khó thu được hydrocarbon tinh khiết bằng cách chưng cất dầu thô?
b) Undecane (C 11 H 24 ) là một hydrocarbon mạch dài có trong dầu thô. Undecane có thể bị cracking tạo thành pentane và một alkene. Viết phương trình hoá học của phản ứng xảy ra.
Phương pháp giải:
- Phương pháp chưng cất được sử dụng để tách biệt và tinh chế chất lỏng. Việc chưng cất được thực hiện trên nguyên tắc thành phần các chất khí bay hơi khác với thành phần của chúng có trong dung dịch lỏng. Phần chất lỏng thu được sau khi chưng cất (bay hơi và ngưng tụ) chứa chủ yếu chất có nhiệt độ sôi thấp hơn.
- Ở nhiệt độ cao và có mặt của chất xúc tác, có thể xảy ra phản ứng cracking alkane, tạo thành những hợp chất có mạch carbon ngắn hơn.
Lời giải chi tiết:
a) Phương pháp chưng cất được thực hiện dựa trên sự khác biệt về nhiệt độ sôi giữa các chất cần tinh chế. Vì các hydrocarbon có nhiệt độ sôi gần bằng nhau nên khó thu được hydrocarbon tinh khiết bằng cách chưng cất dầu thô.
b)
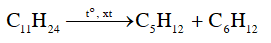
Bài tập Bài 4
Khí thải của động cơ có thể chứa những chất nào gây ô nhiễm môi trường? Có những giải pháp nào để hạn chế ô nhiễm môi trường do khí thải của động cơ?
Phương pháp giải:
Khí thải động cơ, ngoài thành phần là carbon dioxide và hơi nước, còn có thể có carbon monoxide và các oxide của nitrogen (sinh ra từ phản ứng của oxygen với nitrogen trong không khí) và alkane chưa bị cháy hết. Để giảm bớt tác hại của khí thải với môi trường, bên cạnh việc tăng hiệu suất đốt cháy, người ta còn đưa chất xúc tác vào ống xả của động cơ. Nhờ có chất xúc tác, alkane trong khí thải tiếp tục được chuyển hoá thành carbon dioxide và nước; carbon monoxide và các oxide của nitrogen được chuyển hóa thành carbon dioxide và nitrogen.
Lời giải chi tiết:
- Khí thải gây ô nhiễm môi trường của động cơ: carbon dioxide, carbon monoxide, các oxide của nitrogen, alkane chưa cháy hết.
- Giải pháp nào để hạn chế ô nhiễm môi trường do khí thải của động cơ:
+ Tăng hiệu suất đốt cháy nhiên liệu của động cơ, tăng chỉ số octane của xăng.
+ Sử dụng chất xúc tác vào ống xả của động cơ để khí thải độc hại được chuyển hoá thành carbon dioxide và nước.
+ Sử dụng nhiên liệu sạch như xăng E5.
+ Bảo dưỡng định kì cho phương tiện giao thông.
+ Sử dụng phương tiện giao thông công cộng, xe điện.