Bài 7. Sulfur và sulfur dioxide trang 42, 43, 44, 45, 46, 47 Hóa học 11 Kết nối tri thức
Trong công nghiệp, sulfur là nguyên liệu ban đầu, còn sulfur dioxide là hợp chất trung gian trong quá trình sản xuất sulfuric acid. Bên cạnh đó, sulfur dioxide cũng là một tác nhân gây ô nhiễm không khí. Vậy, tính chất cơ bản của sulfur, sulfur dioxide là gì và làm thế nào để giảm thiểu tác hại của sulfur dioxide đối với môi trường?
CH tr 42 MĐ
Trong công nghiệp, sulfur là nguyên liệu ban đầu, còn sulfur dioxide là hợp chất trung gian trong quá trình sản xuất sulfuric acid. Bên cạnh đó, sulfur dioxide cũng là một tác nhân gây ô nhiễm không khí.
Vậy, tính chất cơ bản của sulfur, sulfur dioxide là gì và làm thế nào để giảm thiểu tác hại của sulfur dioxide đối với môi trường?
Phương pháp giải:
- Tính chất cơ bản của sulfur:
+ Tính chất vật lí: chất rắn, không tan trong nước, ít tan trong alcohol, tan nhiều trong disulfide, nóng chảy ở 113 o C , sôi ở 445 o C.
+ Tính chất hóa học: thể hiện cả tính oxi hóa cả tính khử.
- Tính chất cơ bản của sulfur dioxide:
+ Tính chất vật lí: thể khí, không màu, nặng hơn không khí, mùi hắc, tan nhiều trong nước.
+ Tính chất hóa học: tính acidic oxide, tính oxi hóa, tính khử.
Lời giải chi tiết:
- Tính chất cơ bản của sulfur:
+ Tính chất vật lí: sulfur là chất rắn, không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide. Sulfur nóng chảy ở 113 o C và sôi ở 445 o C.
+ Tính chất hoá học: khi tham gia phản ứng hoá học, sulfur có thể thể hiện tính oxi hoá hoặc tính khử. Trong thực tế, hầu hết các phản ứng của sulfur chỉ xảy ra khi đun nóng.
- Tính chất cơ bản của sulfur dioxide:
+ Tính chất vật lí: Ở điều kiện thường, sulfur dioxide là chất khí không màu, nặng hơn không khí, mùi hắc, tan nhiều trong nước.
+ Tính chất hoá học: khi tham gia phản ứng hoá học, sulfur dioxide thể hiện tính chất của acidic oxide. Ngoài ra, sulfur dioxide còn thể thể hiện tính oxi hoá hoặc tính khử.
- Một số biện pháp giảm thiểu tác hại của sulfur dioxide với môi trường: xử lí khí thải của nhà máy trước khi thải khí ra môi trường; chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm môi trường hơn…
CH tr 43 CH1
Kể tên một ứng dụng thực tiễn của quặng pyrite, thạch cao, sulfuric acid mà em biết.
Phương pháp giải:
Dựa vào kiến thức thực tiễn của bản thân
Lời giải chi tiết:
- Ứng dụng của quặng pyrite: nguyên liệu để sản xuất sulfuric acid.
- Ứng dụng của thạch cao: thạch cao được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương.
- Ứng dụng của sulfuric acid: sản xuất thuốc nhuộm, chất tẩy rửa, phân bón, chất dẻo, tơ sợi, giấy, thuốc nổ …
CH tr 43 HĐ
1. Viết cấu hình electron của nguyên tử S (Z = 16) và biểu diễn sự phân bố electron vào các ô orbital.
2. Dựa vào cấu hình elecron và độ âm điện của nguyên tử S, hãy đưa ra dự đoán về:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Tính oxi hoá, tính khử của sulfur.
Phương pháp giải:
1. Che nguyên tử sulfur: 1s 2 2s 2 2p 6 3s 2 3p 4 .
2. a) Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) S có khả năng thể hiện cả tính oxi hóa lẫn tính khử.
Lời giải chi tiết:
1. Cấu hình electron của nguyên tử sulfur là: 1s 2 2s 2 2p 6 3s 2 3p 4 .
Cấu hình electron theo ô orbital:

2. a) Ở trạng thái cơ bản S có 2 electron độc thân; ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Bởi vậy, trong hợp chất của S với các nguyên tố có độ âm điện nhỏ hơn S có số oxi hoá -2; trong các hợp chất cộng hoá trị của S với các nguyên tố có độ âm điện lớn hơn, nguyên tố S có số oxi hoá +4 hoặc +6.
⇒ Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) Khi tham gia phản ứng hoá học S thể hiện tính oxi hoá hoặc tính khử do đơn chất S (số oxi hoá = 0) có số oxi hoá trung gian giữa -2 và +6.
CH tr 43 CH2
Trong tinh thể sulfur, các phân tử S 8 tương tác với nhau bằng lực Van Der Waals yếu. Hãy dự đoán về nhiệt độ nóng chảy (cao hay thấp) của đơn chất sulfur.
Phương pháp giải:
Sulfur dễ nóng chảy, sulfur nóng chảy ở nhiệt độ 113 o C.
Lời giải chi tiết:
Trong tinh thể sulfur, các phân tử S 8 tương tác với nhau bằng lực van der Waals yếu do đó đơn chất sulfur có nhiệt độ nóng chảy thấp, sulfur nóng chảy ở nhiệt độ 113 o C.
CH tr 44 TN
Thí nghiệm: Sulfur tác dụng với sắt (iron)
Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
Tiến hành:
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1 : 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:
Dự đoán sản phẩm tạo thành sau thí nghiệm, viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
Phương pháp giải:

Lời giải chi tiết:

CH tr 45 TN
Thí nghiệm: Sulfur tác dụng với oxygen
Chuẩn bị: bột sulfur, bình khí oxygen, muôi sắt, đèn cồn, nút cao su.
Tiến hành:
- Lấy một ít bột sulfur vào muôi sắt (đã cắm xuyên qua nút cao su).
- Hơ nóng muôi sắt trên ngọn lửa đèn cồn đến khi sulfur nóng chảy và chảy một phần trong không khí.
- Đưa nhanh muôi sắt vào bình khí oxygen.
Quan sát và thực hiện các yêu cầu:
1. Viết phương trình hoá học và xác định chất oxi hoá, chất khử.
2. Nhận xét mức độ phản ứng cháy của sulfur trong không khí và trong khí oxygen
Phương pháp giải:
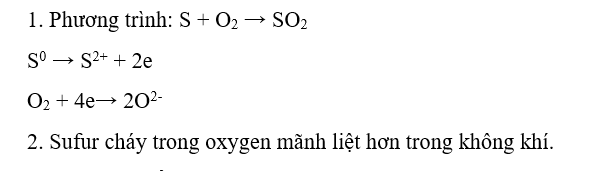
Lời giải chi tiết:
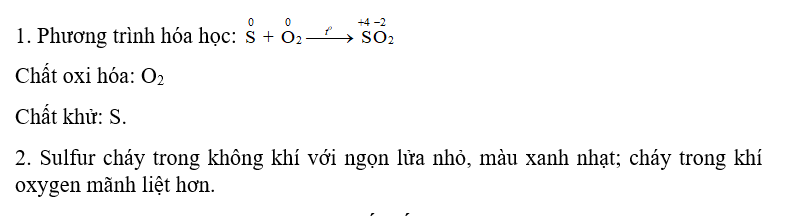
CH tr 45 CH
Phản ứng của sulfur với hydrogen, nhôm (aluminium), thủy ngân (mercury) và fluorine, hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố. Sulfur là chất oxi hóa hay chất khử?
Phương pháp giải:

Lời giải chi tiết:

CH tr 45 HĐ
Sưu tầm thông tin và trình bày về ứng dụng của một hợp chất có chứa nguyên tố sulfur trong thực tiễn.
Lời giải chi tiết:
Ứng dụng của sulfur dioxide (SO 2 ):
Sulfur dioxide là chất trung gian, quan trọng trong quá trình sản xuất sulfuric acid. Oxide này còn được dùng để tẩy trắng vải sợi, đường; sản xuất thuốc trừ sâu và thuốc sát trùng. Trong công nghệ thực phẩm trước kia, sulfur dioxide cũng được sử dụng ở nồng độ nhất định để hạn chế sự phát triển của vi sinh vật. Khí sulfur dioxide cũng được tạo ra từ quá trình đốt cháy sulfur với mục đích diệt khuẩn và nấm mốc, được dùng để bảo quản hoa quả sấy khô, dược liệu từ thực vật (dân gian gọi là quá trình “xông sinh”). Tuy nhiên, ngày nay biện pháp bảo quản này đã bị cấm sử dụng do không đảm bảo an toàn thực phẩm.
CH tr 46 HĐ
1. Sulfur dioxide là oxide acid (acidic oxide). Viết phương trình hoá học minh họa.
2. Dựa vào số oxi hoá của sulfur trong hợp chất sulfur dioxide, hãy dự đoán tính oxi hoá, tính khử của sulfur dioxide.
Phương pháp giải:
1. Sulfur dioxide là oxide acid vì vậy có phản ứng với nước tạo thành acid tương ứng, phản ứng với oxide base và base tạo muối tương ứng.
2. Số oxi hóa của sulfur trong SO 2 là +4 nên có thể tăng hoặc giảm => SO 2 có thể bị khử hoặc oxi hoá.
Lời giải chi tiết:
1. Phương trình minh hoạ:
SO 2 + H 2 O ⇌ H 2 SO 3
SO 2 + BaO → BaSO 3
SO 2 + Ca(OH) 2 → CaSO 3 + H 2 O.
2. Trong hợp chất sulfur dioxide (SO 2 ), nguyên tố sulfur có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, SO 2 có thể bị khử hoặc oxi hoá.
CH tr 46 CH
Hãy xác định sự thay đổi số oxi hóa của nguyên tử các nguyên tố và vai trò của sulfur dioxide trong phản ứng của sulfur dioxide với hydrogen sulfide và nitrogen dioxide.
Phương pháp giải:

Lời giải chi tiết:

CH tr 47 CH
a) Trình bày ứng dụng của sulfur dioxide. Giải thích.
b) Kể tên một số nguồn phát thải sulfur dioxide vào khí quyển. Em hãy đề xuất một số biện pháp nhằm cắt giảm sự phát thải đó.
Phương pháp giải:
a) Ứng dụng của sulfur dioxide: nguyên liệu sản xuất sulfuric acid, tẩy trắng bột giấy, khử màu trong sản xuất đường, chống thấm mốc cho sản phẩm mây tre đan, là dung môi,…
b) Nguồn phát thải khí sulfur dioxide: từ tự nhiên, từ nhân tạo.
Biện pháp: tăng cường sử dụng năng lượng sạch, tiết kiệm tài nguyên thiên nhiên, tái chế sản phẩm phụ chứa sulfur.
Lời giải chi tiết:
a) Sulfur dioxide là chất trung gian trong quá trình sản xuất sulfuric acid.
Do có khả năng tẩy trắng và diệt khuẩn, sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây, tre đan,…
Trong nghiên cứu, sulfur dioxide lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
b) Một số nguồn phát thải khí sulfur dioxide vào khí quyển:
- Nguồn tự nhiên: Khí thải núi lửa, trên toàn thế giới, nguồn sulfur dioxide tự nhiên chiếm ưu thế, nhưng ở các khu vực đô thị và công nghiệp, nguồn nhân tạo chiếm ưu thế.
- Nguồn nhân tạo: Chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid, …
Dựa trên các nguồn phát sinh sulfur dioxide do hoạt động của con người, các biện pháp để cắt giảm sự phát thải khí này được đề xuất như sau:
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.