Lý thuyết Sulfur và sulfur dioxide - Hóa học 11 - Kết nối tri thức
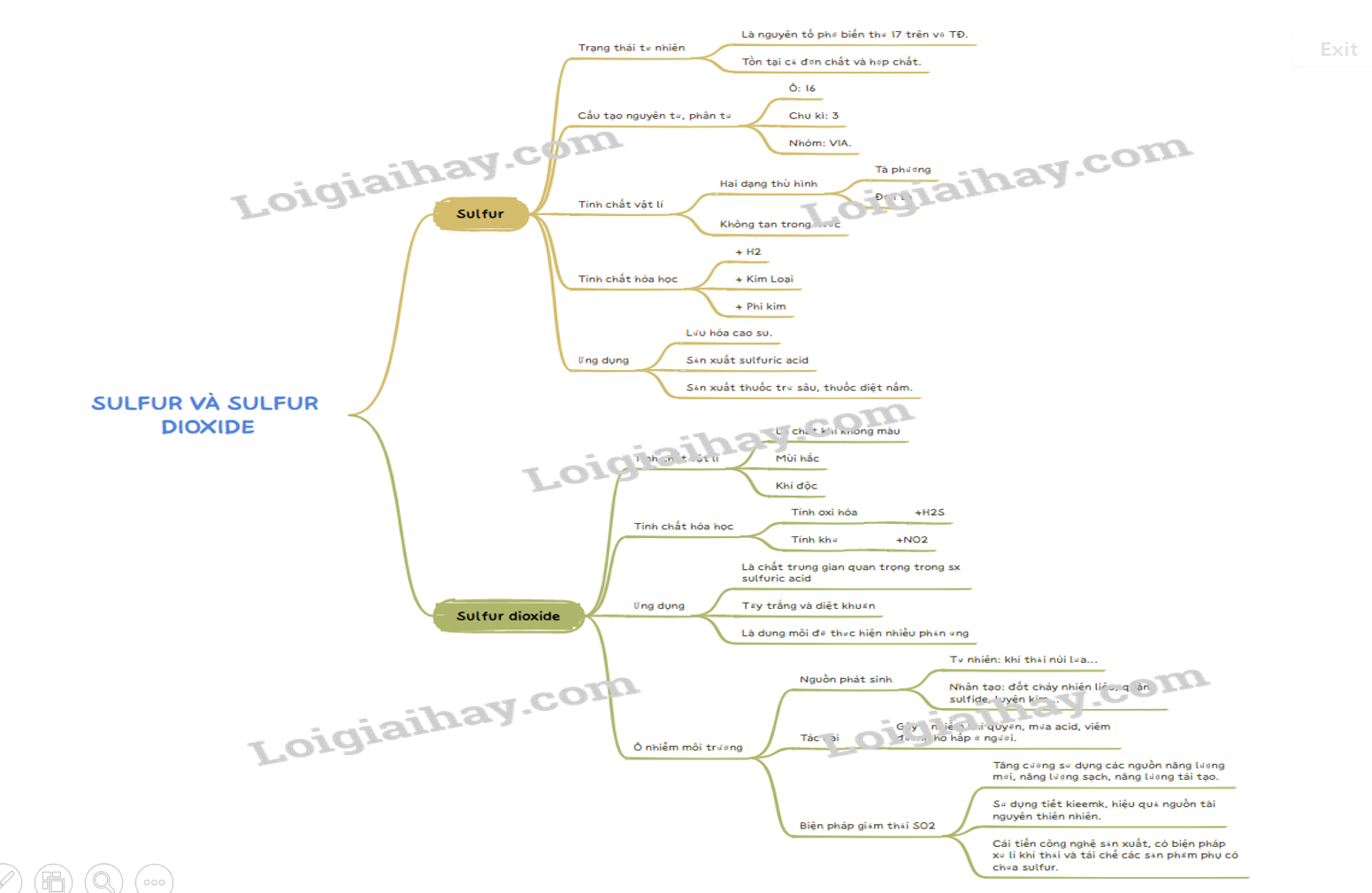
1. Trạng thái tự nhiên - Là nguyên tố phổ biến thứ 17 trên vỏ TĐ. - Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
I. Sulfur
1. Trạng thái tự nhiên
- Là nguyên tố phổ biến thứ 17 trên vỏ TĐ.
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
2. Cấu tạo nguyên tử, phân tử
a, Cấu tạo nguyên tử
- Vị trí trong BTH:
+ Ô: 16.
+ Chu kì: 3.
+ Nhóm: VIA.
- Sulfur có tính phi kim.
- Số oxi hóa: -2, 0, +4, +6.
b, Cấu tạo phân tử
Phân tử sulfur gồm 8 nguyên tử (S 8 ) có dạng vòng khép kín.
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết CHT không phân cực.
3. Tính chất vật lí
- Có hai dạng thù hình: dạng tà phương và dạng đơn tà.
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide.
4. Tính chất hóa học
a, Tác dụng với hydrogen và kim loại
- Tác dụng với hydrogen
S(s) +H 2 (g) H 2 S(g)
- Tác dụng với kim loại tạo ra muối sulfide
Hg + S → HgS
2Al + 3S → Al 2 S 3
b, Tác dụng với phi kim
S + 3F 2 → SF 6
S + O 2 → SO 2
5. Ứng dụng
- Lưu hóa cao su.
- Sản xuất sulfuric acid.
- Sản xuất thuốc trừ sâu, thuốc diệt nấm.
II. Sulfur dioxide
1. Tính chất vật lí
- SO 2 là chất khí không màu, năng hơn không khí, mùi hắc, tan nhiều trong nước.
- SO 2 là khí độc.
2. Tính chất hóa học
a, Tính oxi hóa
- Tác dụng với hydrogen sulfide: SO 2 + 2H 2 S → 3S + 2H 2 O
b, Tính khử
- Tác dụng với nitrogen dioxide (NO 2 ): SO 2 + NO 2 →SO 3 + NO
3. Ứng dụng
- Là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Tẩy trắng và diệt khuẩn.
- Là dung môi để thực hiện nhiều phản ứng.
4. Sulfur dioxide và ô nhiễm môi trường
a, Nguồn phát sinh
- Tự nhiên: khí thải núi lửa …
- Nhân tạo: đốt cháy nhiên liệu, quặng sulfide, luyện kim ….
b, Tác hại
- Gây ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
c, Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
SƠ ĐỒ TƯ SUY