Bài tập chủ đề 2 trang 72 Khoa học tự nhiên 8 Cánh diều
Trong các chất sau, chất nào là acid, base, kiềm? HCl, CuO, KOH, CaCO3, H2SO4, Fe(OH)2.
CH tr 72 BT1
Trong các chất sau, chất nào là acid, base, kiềm?
HCl, CuO, KOH, CaCO 3 , H 2 SO 4 , Fe(OH) 2 .
Phương pháp giải:
Dựa vào khái niệm của acid, base và muối
Lời giải chi tiết:
- Chất là acid: HCl, H 2 SO 4 .
- Chất là base: KOH, Fe(OH) 2 .
- Chất là kiềm: KOH.
CH tr 72 BT2
Trong các chất sau, chất nào là muối, oxide base, oxide acid: CuSO 4 , SO 2 , MgCl 2 , CaO, Na 2 CO 3 . Viết tên gọi các muối.
Phương pháp giải:
Dựa vào khái niệm acid, oxide và muối để phân loại các chất
Lời giải chi tiết:
- Chất là muối: CuSO 4 ; MgCl 2 ; Na 2 CO 3 .
Tên gọi các muối:
CuSO 4 : copper (II) sulfate.
MgCl 2 : magnesium chloride.
Na 2 CO 3 : sodium carbonate.
- Chất là oxide base: CaO.
- Chất là oxide acid: SO 2 .
CH tr 72 BT3
Chất nào trong dãy chất sau: CuO, Mg(OH) 2 , Fe, SO 2 , HCl, CuSO 4 tác dụng được với:
a) Dung dịch NaOH.
b) Dung dịch H 2 SO 4 loãng.
Viết phương trình hoá học của các phản ứng (nếu có).
Phương pháp giải:
Dựa vào tính chất hóa học của base và acid để trả lời câu hỏi và viết phương trình
Lời giải chi tiết:
a) Các chất tác dụng được với dung dịch NaOH là: SO 2 , HCl, CuSO 4 .
Phương trình hoá học minh hoạ:
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
HCl + NaOH → NaCl + H 2 O
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4 .
b) Các chất tác dụng được với dung dịch H 2 SO 4 loãng là: CuO, Mg(OH) 2 , Fe.
Phương trình hoá học minh hoạ:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
Mg(OH) 2 + H 2 SO 4 → MgSO 4 + 2H 2 O
Fe + H 2 SO 4 (loãng) → FeSO 4 + H 2 ↑.
CH tr 72 BT4
Viết các phương trình hoá học theo các sơ đồ sau:
a) HCl + ? → NaCl + H 2 O
b) NaOH + ? → Cu(OH) 2 ↓ + ?
c) KOH + ? → K 2 SO 4 + ?
d) Ba(NO 3 ) 2 + ? → BaSO 4 ↓ + ?
Phương pháp giải:
Dựa vào tính chất hóa học của muối, acid, base
Lời giải chi tiết:
a) HCl + NaOH → NaCl + H 2 O
b) 2NaOH + CuCl 2 → Cu(OH) 2 ↓ + 2NaCl
c) 2KOH + CuSO 4 → K 2 SO 4 + Cu(OH) 2 ↓
d) Ba(NO 3 ) 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaNO 3 .
CH tr 72 BT5

Phương pháp giải:
Dựa vào tính chất hóa học của acid, base và muối để hoàn thành sơ đồ hóa học.
Lời giải chi tiết:
a)
CuO + H 2 SO 4 → CuSO 4 + H 2 O
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4 .
b)
Mg + 2HCl → MgCl 2 + H 2 ↑
MgCl 2 + 2NaOH → Mg(OH) 2 ↓ + 2NaCl.
c)
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O
Na 2 SO 4 + BaCl 2 → 2NaCl + BaSO 4 ↓.
d)
K 2 CO 3 + CaCl 2 → CaCO 3 ↓ + 2KCl
CaCO 3 + 2HCl → CaCl 2 + CO 2 ↑ + H 2 O.
CH tr 72 BT6
Cho 100 mL dung dịch Na 2 SO 4 0,5 M tác dụng vừa đủ với dung dịch BaCl 2 thì thu được m gam kết tủa.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Tính m.
c) Tính nồng độ mol của dung dịch BaCl 2 , biết thể tích dung dịch BaCl 2 đã dùng là 50 mL.
Phương pháp giải:
Dựa vào tính chất hóa học của muối
Lời giải chi tiết:
a) Phương trình hoá học của phản ứng xảy ra:
Na 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2NaCl
b) Đổi 100 ml = 0,1 lít.
Theo bài ra: n Na 2 SO 4 = 0,1 × 0,5 = 0,05 (mol)
Theo phương trình hoá học: n BaSO 4 = nNa 2 SO 4 = 0,05(mol).
Vậy m = 0,05 × (137 + 32 + 16 × 4) = 11,65 (gam).
Theo phương trình hoá học: nBaCl 2 = nNa 2 SO 4 = 0,05(mol).
Đổi 50 mL = 0,05 lít.
Nồng độ mol của dung dịch BaCl 2 là: C M = n : V = 0,05 : 0,05
CH tr 72 BT7
Viết các phương trình hoá học điều chế MgCl 2 trực tiếp từ NgO, Mg(OH) 2 , MgSO 4 .
Phương pháp giải:
Dựa vào tính chất của acid, base, muối.
Lời giải chi tiết:
Các phương trình hoá học:
MgO + 2HCl → MgCl 2 + H 2 O
Mg(OH) 2 + 2HCl → MgCl 2 + 2H 2 O
MgSO 4 + BaCl 2 → MgCl 2 + BaSO 4 ↓.
CH tr 72 BT8
Biết dung dịch NaCl có pH bằng 7. Chỉ dùng quỳ tím, nêu cách nhận biết các dung dịch không màu, đựng trong ba ống nghiệm riêng rẽ: NaOH, HCl và NaCl.
Phương pháp giải:
Dựa vào tính chất của acid, base, muối.
Lời giải chi tiết:
Cho vào mỗi ống nghiệm một mẩu quỳ tím:
- Quỳ tím chuyển sang màu xanh → dung dịch NaOH.
- Quỳ tím chuyển sang màu đỏ → dung dịch HCl.
- Quỳ tím không chuyển màu → dung dịch NaCl.
CH tr 72 BT9
Việc bón phân NPK cho cây cà phê sau khi trồng bốn năm thời kì như sau:
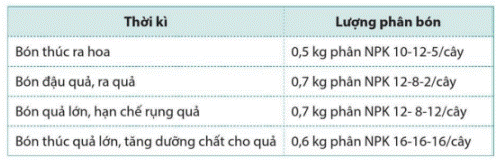 được chia thành bốn
được chia thành bốn
a) Tính lượng N đã cung cấp cho cây trong cả bốn thời kì.
b) Nguyên tố dinh dưỡng potassium được bổ sung cho cây nhiều nhất ở thời kì nào?
Phương pháp giải:
Dựa vào công thức tính % khối lượng nguyên tố.
Lời giải chi tiết:
Chú ý: Các số sau chữ NPK, ví dụ NPK 10 – 12 – 5 cho biết hàm lượng dinh dưỡng có trong phân.
a) Lượng N cung cấp cho cây trong thời kì bón thúc ra hoa là:
0,5 × 10 : 100 = 0,05(kg).
Lượng N cung cấp cho cây trong thời kì bón đậu quả, ra quả là:
0,7 × 12 : 100 = 0,084(kg).
Lượng N cung cấp cho cây trong thời kì bón quả lớn, hạn chế rụng quả là:
0,7 × 12 : 100 = 0,084(kg).
Lượng N cung cấp cho cây trong thời kì bón thúc quả lớn, tăng dưỡng chất cho quả là:
0,6 × 16 : 100 = 0,096(kg).
Lượng N đã cung cấp cho cây trong cả bốn thời kì là:
0,05 + 0,084 + 0,084 + 0,096 = 0,314 (kg).
b) Nguyên tố dinh dưỡng potassium được bổ sung cho cây nhiều nhất ở thời kì bón thúc quả lớn, tăng dưỡng chất cho quả.