Bài 12. Muối trang 62, 63, 64, 65, 66, 67 Khoa học tự nhiên 8 Cánh diều
Muối là loại hợp chất có nhiều trong tự nhiên, trong nước biển, trong đất, trong các mỏ (hình 12.1). Vậy muối là gì? Muối có những tính chất hoá học nào? Mối liên hệ giữa muối với các loại hợp chất khác được thể hiện như thế nào?
CH tr 62 MĐ
Muối là loại hợp chất có nhiều trong tự nhiên, trong nước biển, trong đất, trong các mỏ (hình 12.1). Vậy muối là gì? Muối có những tính chất hoá học nào? Mối liên hệ giữa muối với các loại hợp chất khác được thể hiện như thế nào?
Lời giải chi tiết:
- Muối là những hợp chất được tạo ra khi thay thế ion H + trong acid bằng ion kim loại hoặc ion ammonium (NH 4 + ).
- Tính chất hoá học của muối:
+ Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
+ Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
+ Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
+ Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
- Mối liên hệ giữa muối và các hợp chất khác được thể hiện bằng sơ đồ sau:
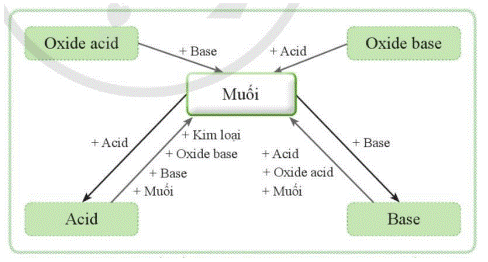
CH tr 63 CH
Cho biết các muối: Na 3 PO 4 , MgCl 2 , CaCO 3 , CuSO 4 , KNO 3 tương ứng với acid nào trong số các acid sau: HCl, H 2 SO 4 , H 3 PO 4 , HNO 3 , H 2 CO 3 .
Lời giải chi tiết:
|
Muối |
Na 3 PO 4 |
MgCl 2 |
CaCO 3 |
CuSO 4 |
KNO 3 |
|
Acid tương ứng |
H 3 PO 4 |
HCl |
H 2 CO 3 |
H 2 SO 4 |
HNO 3 |
CH tr 63 LT1
Gọi tên các muối sau: KCl, ZnSO 4 , MgCO 3 , Ca 3 (PO 4 ) 2 , Cu(NO 3 ) 2 , Al 2 (SO 4 ) 3 .
Phương pháp giải:
Tên muối = tên cation + tên anion
|
Công thức hoá học |
Tên gọi |
|
KCl |
Potassium chloride |
|
ZnSO 4 |
Zinc sulfate |
|
MgCO 3 |
Magnesium carbonate |
|
Ca 3 (PO 4 ) 2 |
Calcium phosphate |
|
Cu(NO 3 ) 2 |
Copper(II) nitrate |
|
Al 2 (SO 4 ) 3 |
Aluminium sulfate |
Lời giải chi tiết:
|
Công thức hoá học |
Tên gọi |
|
KCl |
Potassium chloride |
|
ZnSO 4 |
Zinc sulfate |
|
MgCO 3 |
Magnesium carbonate |
|
Ca 3 (PO 4 ) 2 |
Calcium phosphate |
|
Cu(NO 3 ) 2 |
Copper(II) nitrate |
|
Al 2 (SO 4 ) 3 |
Aluminium sulfate |
CH tr 63 LT2
Sử dụng bảng tính tan, cho biết muối nào sau đây tan được trong nước: K 2 SO 4 , Na 2 CO 3 , AgNO 3 , KCl, CaCl 2 , BaCO 3 , MgSO 4
Phương pháp giải:
Sử dụng bảng tính tan của muối.
Lời giải chi tiết:
Các muối tan trong nước là: K 2 SO 4 , Na 2 CO 3 , AgNO 3 , KCl, CaCl 2 , MgSO 4 .
CH tr 64 LT3
Dung dịch CuSO 4 có màu xanh lam, dung dịch ZnSO 4 không màu. Viết phương trình hoá học xảy ra khi ngâm Zn trong dung dịch CuSO 4 , dự đoán sự thay đổi về màu của dung dịch trong quá trình trên.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Kim loại tác dụng với muối.
- Phương trình hoá học xảy ra: Zn + CuSO 4 → ZnSO 4 + Cu.
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
Lời giải chi tiết:
- Phương trình hoá học xảy ra: Zn + CuSO 4 → ZnSO 4 + Cu.
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
CH tr 64 LT4
Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
a) Cho Fe vào dung dịch CuSO 4 .
b) Cho Zn vào dung dịch AgNO 3 .
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Kim loại tác dụng với muối.
Lời giải chi tiết:
Phương trình hoá học xảy ra:
a) Fe + CuSO 4 → FeSO 4 + Cu.
b) Zn + 2AgNO 3 → Zn(NO 3 ) 2 + 2Ag.
CH tr 64 TH1
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, miếng bìa màu trắng.
● Hoá chất: Mẩu dây đồng, dung dịch AgNO 3 .
Tiến hành
● Cho mẩu dây đồng (dài khoảng 2 cm) vào ống nghiệm, thêm vào ống nghiệm khoảng 2 ml dung dịch AgNO 3 . Đặt miếng bìa trắng sau ống nghiệm.
● Mô tả các hiện tượng xảy ra.
● Bề mặt sợi dây đồng và màu dung dịch trong ống nghiệm thay đổi như thế nào? Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Mẩu dây đồng tan dần, có lớp kim loại trắng bạc bám ngoài dây đồng, dung dịch sau phản ứng có màu xanh.
- Bề mặt sợi dây đồng có lớp kim loại trắng bạc, dung dịch trong ống nghiệm đậm màu dần. Do dung dịch AgNO 3 đã phản ứng với kim loại Cu theo phương trình hoá học sau:
2AgNO 3 + Cu → Cu(NO 3 ) 2 + 2Ag↓.
Dung dịch Cu(NO 3 ) 2 có màu xanh.
CH tr 64 TH2
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch BaCl 2 , dung dịch H 2 SO 4 loãng.
Tiến hành
● Lấy khoảng 2 ml dung dịch BaCl 2 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt H 2 SO 4 vào ống nghiệm (khoảng 5 giọt).
● Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch BaCl 2 phản ứng với dung dịch H 2 SO 4 tạo thành kết tủa trắng là BaSO 4 . Phương trình hoá học:
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl.
CH tr 65 LT5
Dự đoán các hiện tượng xảy ra trong các thí nghiệm sau:
a) Nhỏ dung dịch H 2 SO 4 loãng vào dung dịch Na 2 CO 3 .
b) Nhỏ dung dịch HCl loãng vào dung dịch AgNO 3 .
Giải thích và viết phương trình hoá học xảy ra (nếu có).
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với acid.
Lời giải chi tiết:
a) Hiện tượng: có khí thoát ra.
Giải thích: H 2 SO 4 loãng tác dụng với Na 2 CO 3 sinh ra khí CO 2 theo phương trình hoá học: H 2 SO 4 + Na 2 CO 3 → Na 2 SO 4 + CO 2 ↑ + H 2 O.
b) Hiện tượng: xuất hiện kết tủa trắng.
Giải thích: HCl tác dụng với AgNO 3 sinh ra kết tủa trắng là AgCl theo phương trình hoá học: HCl + AgNO 3 → AgCl↓ + HNO 3 .
CH tr 65 TH3
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch CuSO 4 , dung dịch NaOH.
Tiến hành
● Lấy khoảng 2 mL dung dịch CuSO 4 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm.
● Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với base.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
- Giải thích: CuSO 4 tác dụng với NaOH sinh ra kết tủa Cu(OH) 2 có màu xanh. Phương trình hoá học: CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4 .
CH tr 65 LT6
Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch FeCl 3 tác dụng với dung dịch NaOH.
b) Dung dịch CuCl 2 tác dụng với dung dịch KOH.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với base.
Lời giải chi tiết:
a) FeCl 3 + 3NaOH → Fe(OH) 3 ↓ + 3NaCl
b) CuCl 2 + 2KOH → Cu(OH) 2 ↓ + 2KCl
CH tr 66 TH4
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch Na 2 CO 3 , dung dịch CaCl 2 .
Tiến hành
Lấy khoảng 2 mL dung dịch Na 2 CO 3 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt CaCl 2 vào ống nghiệm.
Báo cáo kết quả, thảo luận
Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch Na 2 CO 3 tác dụng với dung dịch CaCl 2 sinh ra kết tủa trắng là CaCO 3 theo phương trình hoá học:
Na 2 CO 3 + CaCl 2 → CaCO 3 ↓ + 2NaCl.
CH tr 66 LT8
Viết phương trình hoá học xảy ra giữa các dung dịch sau:
a) Dung dịch NaCl với dung dịch AgNO 3 .
b) Dung dịch Na 2 SO 4 với dung dịch BaCl 2 .
c) Dung dịch K 2 CO 3 với dung dịch Ca(NO 3 ) 2 .
Phương pháp giải:
Sử dụng tính chất hóa học của muối: Muối tác dụng với muối.
Lời giải chi tiết:
a) NaCl + AgNO 3 → AgCl↓ + NaNO 3 .
b) Na 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2NaCl.
c) K 2 CO 3 + Ca(NO 3 ) 2 → CaCO 3 ↓ + 2KNO 3 .
CH tr 66 LT9
Viết các phương trình hoá học theo sơ đồ chuyển hoá sau:
CuO → CuSO 4 → CuCl 2 → Cu(OH) 2
Phương pháp giải:
Sửa dụng tính chát hóa học của muối và oxide base.
Các phương trình hoá học theo sơ đồ:
(1) CuO + H 2 SO 4 → CuSO 4 + H 2 O.
(2) CuSO 4 + BaCl 2 → BaSO 4 ↓ + CuCl 2 .
(3) CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl.
Lời giải chi tiết:
Các phương trình hoá học theo sơ đồ:
(1) CuO + H 2 SO 4 → CuSO 4 + H 2 O.
(2) CuSO 4 + BaCl 2 → BaSO 4 ↓ + CuCl 2 .
(3) CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl.
CH tr 67 VD
Muối Al 2 (SO 4 ) 3 được dùng trong công nghiệp để nhuộm vải, thuộc da, làm trong nước, … Tính khối lượng Al 2 (SO 4 ) 3 tạo thành khi cho 51 kg Al 2 O 3 tác dụng hết với dung dịch H 2 SO 4 .
Phương pháp giải:
Đổi 51 kg = 51000 gam.
nAl 2 O 3 = 51000 : 102 = 500 (mol)
Phương trình hoá học:
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 O
Theo phương trình hoá học có:
nAl 2 (SO 4 ) 3 =nAl 2 O 3 = 500 (mol)
Khối lượng Al 2 (SO 4 ) 3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171000 gam = 171 kg.
Lời giải chi tiết:
Đổi 51 kg = 51000 gam.
nAl 2 O 3 = 51000 : 102 = 500 (mol)
Phương trình hoá học:
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 O
Theo phương trình hoá học có:
nAl 2 (SO 4 ) 3 =nAl 2 O 3 = 500 (mol)
Khối lượng Al 2 (SO 4 ) 3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171000 gam = 171 kg.