Bài 12. Alkane trang 51, 52, 53, 54, 55 SBT Hóa 11 Chân trời sáng tạo
Theo ước tính, trung bình mỗi ngày một con bò “ợ” vào bầu khí quyển khoảng 250 L – 300
12.1
Theo ước tính, trung bình mỗi ngày một con bò “ợ” vào bầu khí quyển khoảng 250 L – 300 L một chất khí có khả năng gây hiệu ứng nhà kính. Khi đó là
A. O 2 . B. CO 2 . C. CH 4 . D. NH 3 .
Phương pháp giải:
Các chất khí gây hiệu ứng nhà kính điển hình là CO 2 và CH 4 .
Lời giải chi tiết:
CO 2 và CH 4 có khả năng gây hiệu ứng nhà kính. Tuy nhiên, CH 4 là khí do bò “ợ” ra.
→ Chọn C .
12.2
Biogas là một loại khí sinh học, được sản xuất bằng cách ủ kín các chất thải hữu cơ trong chăn nuôi, sinh hoạt. Biogas được dùng để đun nấu, chạy máy phát điện sinh hoạt gia đình. Thành phần chính của biogas là
A. N 2 . B. CO 2 . C. CH 4 . D. NH 3 .
Phương pháp giải:
Biogas hay khí sinh học là một hỗn hợp khí (chủ yếu là methane, chiếm hơn 60%) được sinh ra từ quá trình phân huỷ kị khí của các phụ phẩm nông nghiệp (chất thải của gia súc, gia cầm, rơm, rạ,...), rác thải hữu cơ,...
Lời giải chi tiết:
Thành phần chính của biogas là methane (CH 4 ).
→ Chọn C .
12.3
Đồ thị dưới đây thể hiện mối tương quan giữa nhiệt độ sôi và số nguyên tử carbon trong phân tử alkane không phân nhánh được biểu diễn như sau:
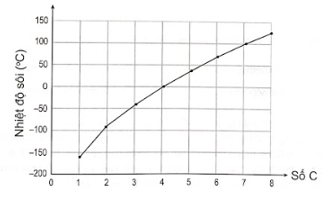
Đồ thị biểu diễn mối tương quan giữa nhiệt độ sôi và số nguyên tử carbon trong phân tử alkane không phân nhánh
Dựa vào đồ thị đã cho, số phân tử alkane không phân nhánh ở thể khí trong điều kiện thường là
A. 4. B. 2. C. 3. D. 1.
Phương pháp giải:
Những chất ở thể khí có nhiệt độ sôi thấp hơn nhiệt đồ phòng.
Lời giải chi tiết:
Trên đồ thị, ta thấy có 4 alkane có nhiệt độ sôi nhỏ hơn nhiệt độ phòng. Do đó, 4 alkane này ở thể khí trong điều kiện thường.
→ Chọn A .
12.3
Alkane (A) có công thức phân tử C 5 H 12 . (A) tác dụng với chlorine khi đun nóng chỉ tạo một dẫn xuất monochloro duy nhất. Tên gọi của (A) là
A. pentane. B. 2-methylbutane.
C. 2,2-dimethylpropane. D. 3-methylbutane.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
Viết các đồng phân của C 5 H 12 (3 đồng phân), rồi thế một Cl vào mỗi công thức, A là công thức chỉ cho ra 1 sản phẩm thế.
Lời giải chi tiết:
Alkane có công thức phân tử C 5 H 12 , tạo ra một dẫn xuất monochloro duy nhất là 2,2 – dimethylpropane.
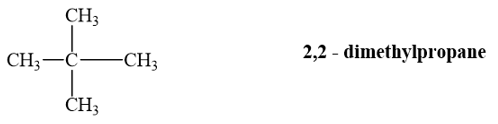
→ Chọn C .
12.5
Có bao nhiêu alkane (có số nguyên tử C ≤ 5) khi tác dụng với chlorine (có ánh sáng hoặc đun nóng) tạo duy nhất một sản phẩm thế monochloro?
A. 3. B. 2. C. 1. D. 4.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
Lời giải chi tiết:
Các alkane (có số nguyên tử C ≤ 5) khi tác dụng với chlorine (có ánh sáng hoặc đun nóng) tạo duy nhất một sản phẩm thế monochloro:

→ Chọn A .
12.6
Khi cho 2,2-dimethylbutane tác dụng với chlorine thu được tối đa bao nhiêu dẫn xuất monochloro?
A. 3. B. 2. C. 5. D. 4.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
Lời giải chi tiết:
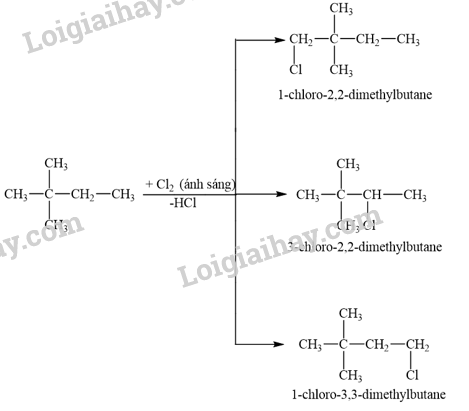
Khi cho 2,2-dimethylbutane tác dụng với chlorine thu được 3 dẫn xuất monochloro.
→ Chọn A .
12.7
Cho alkane sau:
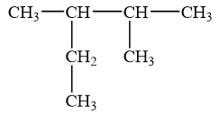
Danh pháp thay thế của alkane trên là
A. 2-ethyl-3-methylbutane. B. 2-methyl-3-ethylbutane.
C. 3,4-dimethylpentane. D. 2,3-dimethylpentane.
Phương pháp giải:
Tên theo danh pháp thay thế của alkane:
+ Alkane không phân nhánh: Tiền tố ứng với số nguyên tử C trong alkane + ane.
+ Alkane phân nhánh: Sổ chỉ vị trí nhánh – Tên nhánh + Tiền tố ứng với số nguyên tử C trong alkane + ane.
Lời giải chi tiết:
Cần chọn mạch chính dài nhất (5 nguyên tử C), nhiều nhánh nhất (hai nhánh). Đánh số thứ tự theo chiều sao cho tổng chỉ số của các nhánh là nhỏ nhất (vị trí số 1 ở đầu mạch carbon và gần nhánh nhất).
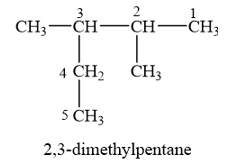
→ Chọn D .
12.8
Để hoàn thành bài tập gọi tên các đồng phân của alkane có công thức phân tử là C 4 H 10 , một bạn học sinh đã vẽ các dạng mạch carbon của alkane này, biết rằng dạng mạch carbon này chỉ chứa các liên kết đơn có thể có, sau đó bạn tiếp tục bổ sung các nguyên tử hydrogen vào dạng mạch carbon để hoàn tất bài tập. Theo em, học sinh đó đã sai ở điểm nào?
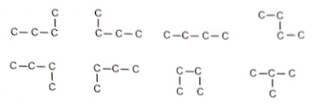
Phương pháp giải:
Chuỗi nguyên tử carbon chỉ chứa liên kết đơn có thể được “bẻ” theo nhiều cách khác nhau vì các liên kết C−C có thể quay tự do.
Lời giải chi tiết:
4 nguyên tử carbon chỉ chứa liên kết đơn có thể được “bẻ” theo nhiều cách khác nhau vì các liên kết C−C có thể quay tự do. Trong hình trên, có 7 cách quay các liên kết C—C trong hình mà vẫn không làm đổi bản chất giữa chúng. Do đó bạn học sinh này chỉ đưa ra được 2 đồng phân của C 4 H 10 .
12.9
So sánh và giải thích nhiệt độ sôi của alkane mạch không phân nhánh với alkane mạch phân nhánh khi chúng có cùng số nguyên tử carbon trong phân tử.
Phương pháp giải:
Tương tác Van der Waals giữa các phân tử càng lớn, nhiệt độ sôi càng cao.
Lời giải chi tiết:
Các phân tử alkane phân nhánh có nhiệt độ sôi thấp hơn các phân tử alkane không phân nhánh dù cho chúng có cùng số nguyên tử carbon. Điều này được giải thích vì các phân tử alkane không phân nhánh có diện tích bề mặt lớn hơn so với phân tử alkane phân nhánh nên tồn tại tương tác van der Waals giữa các phân tử lớn hơn, dẫn đến nhiệt độ sôi cao hơn.
12.10
Mặc dù có 5 nguyên tử carbon trong phân tử nhưng neopentane (2,2-dimethylpropane) ở thể khí trong điều kiện thường. Giải thích.
Phương pháp giải:
Giữa các phân tử có nhánh, hay cấu trúc có tính đối xứng cao, tương tác Van der Waals nhỏ.
Lời giải chi tiết:
Trong số 3 đồng phân của C 5 H 12 , neopentane có cấu trúc đối xứng cao, phân tử xem như có dạng hình cầu nên tương tác van der Waals giữa các phân tử neopentane rất yếu, dẫn đến nhiệt độ sôi của neopentane là 9,5 °C. Điều này làm cho phân tử neopentane ở thể khí trong điều kiện thường (hai đồng phân còn lại là pentane có nhiệt độ sôi ở 36 °C và isopentane có nhiệt độ sôi ở 27,8 °C nên trong điều kiện thường, chúng ở thể lỏng).
12.11
Em hãy cho biết xăng có tan được trong nước hay không và chất béo có tan được trong xăng hay không. Theo em, bác thợ sửa xe thường rửa tay bằng gì để sạch các vết dầu mỡ?
Phương pháp giải:
Alkane không phân cực nên alkane bị hòa tan bởi các dung môi không phân cực hoặc kém phân cực.
Lời giải chi tiết:
Xăng có thành phần chính là các phân tử alkane có số nguyên tử carbon từ 7 – 11 nguyên tử.
Vì xăng là các phân tử không phân cực trong khi nước là phân tử phân cực, nên xăng không tan được trong nước.
Đồng thời, chất béo là hợp chất không phân cực nên chất béo cũng tan được trong xăng. Dầu mỡ sửa chữa xe cũng là các phân tử alkane nên không thể tan được trong nước, điều đó được hiểu là dầu mỡ trên tay bác thợ sửa chữa xe không thể làm sạch chỉ bởi nước. Bác thợ sửa xe thường dùng dầu hoả (là các phân tử alkane có số nguyên tử carbon từ 12 – 15 nguyên tử) để hoà tan các vết dầu mỡ, sau đó rửa lại bằng xà phòng.
12.12
Vì sao khi tiếp xúc lâu dài với xăng sẽ làm cho da bị phồng rộp và gây đau nhức?
Phương pháp giải:
Alkane không phân cực nên alkane lỏng có thể làm dung môi hòa tan các chất không phân cực hoặc kém phân cực.
Lời giải chi tiết:
Vì xăng hay dầu hỏa có thể hòa tan được lớp dầu trên da. Khi tiếp xúc lâu dài với xăng, dầu hoả, ... sẽ làm cho lớp dầu bảo vệ da bị trôi đi, da không còn lớp dầu bảo vệ nên sẽ bị phồng rộp và gây đau nhức.
Khi tiếp xúc với xăng, dầu hoả, dung môi pha sơn, ... cần đeo găng tay cẩn thận.
12.13
Butane là chất lỏng có thể nhìn thấy bên trong một chiếc bật lửa trong suốt, có nhiệt độ sôi thấp hơn một ít so với nhiệt độ của nước đóng băng (–0,5 °C). Tuy nhiên vì sao butane trong bật lửa lại không sôi?
Phương pháp giải:
Khi được đưa vào trong bật lửa, butane chịu áp suất rất cao so với áp suất khí quyển. Ở áp suất cao, nhiệt độ sôi của chất tăng.
Lời giải chi tiết:
Butane trong bật lửa không sôi, mặc dù butane có nhiệt độ sôi thấp hơn một ít so với nhiệt độ của nước đóng băng (–0,5 °C), vì các lý do sau:
+ Khi được đưa vào trong bật lửa, butane chịu áp suất rất cao so với áp suất khí quyển. Điều này làm tăng nhiệt độ sôi của butane lên cao hơn nhiệt độ phòng. Do đó butane không thể sôi ở áp suất cao này.
+ Khi được giải nén, butane lỏng lập tức bốc hơi và tạo khí butane, bốc cháy khi gặp tia lửa do ma sát giữa bánh răng kim loại với đá lửa.
12.14
Cho 2-methylpropane tác dụng với chlorine (tỉ lệ mol 1 : 1, có ánh sáng) thu được tối đa bao nhiêu sản phẩm thế monochloro?
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine).
Lời giải chi tiết:
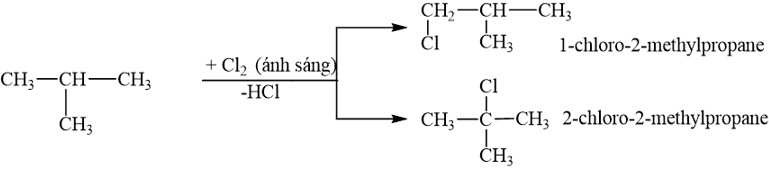
Cho 2-methylpropane tác dụng với chlorine (tỉ lệ mol 1 : 1, có ánh sáng) thu được 2 sản phẩm thế monochloro.
12.15
Khi cho 2-methylpropane tác dụng với bromine ở 127 °C thu được hỗn hợp 2 sản phẩm thế monobromo là 1-bromo-2-methylpropane (0,56%) và 2-bromo-2-methylpropane (99,44%). Xác định tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc III trong phản ứng.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine). Trong phản ứng thế halogen, nguyên tử hydrogen liên kết với nguyên tử carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử hydrogen liên kết với nguyên tử carbon bậc thấp.
Lời giải chi tiết:
2-methylpropane có công thức cấu tạo:
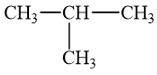
Như vậy 2-methylpropane có 9 nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và 1 nguyên tử hydrogen gắn ở nguyên tử carbon bậc III. Gọi a và k là khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc III trong phản ứng thế bromine đã cho.
Vì sản phẩm thế hydrogen vào carbon bậc I chiếm 0,56% nên ta có phương trình:
\[\frac{{{\rm{9a}}}}{{{\rm{9a + 1k}}}} \times 100\% = 0,56\% \]
Chọn \[{\rm{a}} = 1\]\[ \Rightarrow \frac{9}{{9 + {\rm{k}}}} \times 100\% = 0,56\% \Rightarrow {\rm{k}} \approx 1598\]
Vậy với 2-methylpropane, tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc III trong phản ứng là 1 : 1 598.
12.16
Trong phản ứng thế của propane với chlorine ở nhiệt độ phòng khi có ánh sáng, tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc II tương ứng là 1 : 4.
a) Xác định tỉ lệ phần trăm các sản phẩm thế monochloro thu được trong phản ứng thế trên.
b) Dự đoán khả năng phản ứng và tỉ lệ phần trăm các sản phẩm thế thu được khi thay chlorine bằng bromine.
Phương pháp giải:
Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, các alkane tham gia phản ứng thế với halogen (chlorine, bromine). Trong phản ứng thế halogen, nguyên tử hydrogen liên kết với nguyên tử carbon bậc cao hơn dễ bị thế bởi nguyên tử halogen hơn so với nguyên tử hydrogen liên kết với nguyên tử carbon bậc thấp.
Lời giải chi tiết:
a) Propane CH 3 –CH 2 –CH 3 khi tác dụng với chlorine sẽ thu được 2 sản phẩm thế monochloro là CH 3 -CH 2 -CH 2 Cl và CH 3 -CHCl-CH 3 .
Vì tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn ở nguyên tử carbon bậc I và nguyên tử carbon bậc II tương ứng là 1 : 4 nên tổng khả năng phản ứng của 8 nguyên tử hydrogen (gồm 6 nguyên tử hydrogen gắn vào carbon bậc I và 2 nguyên tử hydrogen gắn vào carbon bậc II) là \[6 \times 1 + 2 \times 4 = 14\]
\[ \Rightarrow \]Tỉ lệ phần trăm của sản phẩm CH 3 -CH 2 -CH 2 Cl là \[\frac{{6 \times 1}}{{14}} \times 100\% \approx 42,86\% \]
\[ \Rightarrow \] Tỉ lệ phần trăm của sản phẩm CH 3 -CHCl-CH 3 là \[\frac{{2 \times 4}}{{14}} \times 100\% \approx 57,14\% \]
b) Phản ứng của propane với bromine sẽ xảy ra chậm hơn so với phản ứng của propane với chlorine. Tuy nhiên lúc này, do bromine có tính chọn lọc hơn so với chlorine nên khả năng phản ứng của nguyên tử carbon bậc II cao hơn nhiều so với của nguyên tử carbon bậc I, dẫn đến sản phẩm thế CH 3 –CHBr–CH 3 sẽ chiếm tỉ lệ phần trăm cao hơn nhiều so với sản phẩm thế CH 3 –CH 2 –CH 2 Br.
12.17
Giải thích tại sao các bể chứa xăng thường được quét một lớp nhũ màu trắng bạc?
Phương pháp giải:
Xăng dễ cháy, khi cháy tỏa ra nhiều nhiệt. Do đó cần đựng xăng bằng các bể chứa hấp thụ nhiệt kém.
Lời giải chi tiết:
Lớp nhũ màu trắng bạc phản xạ tốt các tia nhiệt (hấp thụ các tia nhiệt kém) nên hạn chế được sự truyền nhiệt từ bên ngoài vào, nhờ đó xăng đỡ nóng hơn, tránh hiện tượng gây cháy nổ bể.
12.18
Phân tích thành phần nguyên tố của hợp chất hữu cơ (X) thu được kết quả %C và %H (theo khối lượng) lần lượt là 84,21% và 15,79%. Phân tử khối của hợp chất (X) này được xác định thông qua kết quả phổ khối lượng) như hình bên dưới với peak ion phân tử có giá trị m/z lớn nhất.
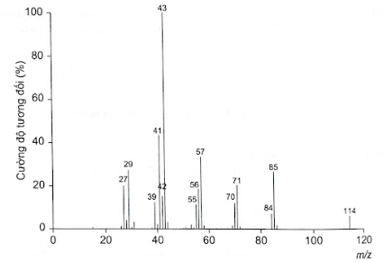
a) Xác định công thức phân tử của (X).
b) Nếu không có kết quả phân tích phổ khối lượng của (X), trình bày cách xác định công thức phân tử của (X) dựa trên những dữ kiện em đã biết.
Phương pháp giải:
a) Có thể dự đoán phân tử khối của hợp chất hữu cơ đơn giản bằng tín hiệu của mảnh ion phân tử (kí hiệu là [M + ]). Mảnh ion phân tử này thường ứng với tín hiệu có giá trị m/z lớn nhất.
Thiết lập công thức phân tử hợp chất hữu cơ (C x H y O z N t ) từ dữ liệu phân tích nguyên tố và phân tử khối (M) được khái quát như sau:
\[{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\]
Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %m C , %m H , %m O , %m N lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ.
b) Tìm công thức đơn giản nhất của (X) và kết hợp với điều kiện sau:
Trong hợp chất C x H y O z bất kì, ta có: \[{\rm{y}} \le 2{\rm{x}} + 2\]
Lưu ý: Số H trong hợp chất hydrocarbon (hoặc hợp chất chứa C, H, O) luôn luôn là số chẵn
Lời giải chi tiết:
a) Vì \[\% {{\rm{m}}_{\rm{H}}} + \% {{\rm{m}}_{\rm{C}}} = {\rm{ 15,79\% + 84,21\% = }}100\% \] nên phân tử (X) chỉ chứa nguyên tố hydrogen và carbon.
Gọi công thức phân tử của (X) là C x H y .
Khối lượng mol phân tử của (X) được xác định trên phổ khối lượng tương ứng với peak có giá trị m/z lớn nhất. Do đó, từ phổ khối lượng của (X), ta có: \[{{\rm{M}}_{\left( X \right)}} = 114\]
\[\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{84,21}}{{{\rm{12}}}} \times \frac{{114}}{{{\rm{100}}}} \approx 8\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{15,79}}{{\rm{1}}} \times \frac{{114}}{{{\rm{100}}}} \approx 18\end{array}\]
Vậy công thức phân tử của (X) là C 8 H 18 .
b) Vì \[\% {{\rm{m}}_{\rm{H}}} + \% {{\rm{m}}_{\rm{C}}} = {\rm{ 15,79\% + 84,21\% = }}100\% \] nên phân tử (X) chỉ chứa nguyên tố hydrogen và carbon.
Gọi công thức đơn giản nhất của (X) là C x H y .
\[\begin{array}{l}{\rm{x}}:{\rm{y}} = \frac{{\% {\rm{C}}}}{{12}}:\frac{{\% {\mathop{\rm H}\nolimits} }}{1} = \frac{{84,21}}{{12}}:\frac{{15,79}}{1}\\{\rm{ = 7,0175}}:15,79 \approx 4:9\end{array}\]
\[ \Rightarrow \] Công thức đơn giản nhất của (X) là (C 4 H 9 ) n hay C 4n H 9n .
Vì trong hợp chất C x H y O z bất kì, ta có: \[{\rm{y}} \le 2{\rm{x}} + 2 \Leftrightarrow 4{\rm{n}} \le 2 \times 4{\rm{n}} + 2 \Rightarrow {\rm{n}} \le 2\]
+) Với \[{\rm{n}} = 1\], công thức phân tử của (X) là C 4 H 9 \[ \Rightarrow \]Loại trường hợp này vì số H trong hợp chất hydrocarbon luôn luôn là số chẵn.
+) Với \[{\rm{n}} = 2\], công thức phân tử của (X) là C 8 H 18 (nhận).
Vậy công thức phân tử của (X) là C 8 H 18 .
12.19
Gọi tên alkane sau theo danh pháp thay thế:

Phương pháp giải:
- Tên theo danh pháp thay thế của alkane:
+ Alkane không phân nhánh: Tiền tố ứng với số nguyên tử C trong alkane + ane.
+ Alkane phân nhánh: Sổ chỉ vị trí nhánh – Tên nhánh + Tiền tố ứng với số nguyên tử C trong alkane + ane.
- Lưu ý:
+ Để đọc tên nhánh này, carbon của nhánh phức tạp gắn vào mạch chính được đánh số 1. Tên nhánh phức tạp được cho vào ngoặc. Khi gọi tên nhánh, ưu tiên theo thứ tự chữ cái của nhánh, không ưu tiên theo chữ cái của các tiếp đầu ngữ iso, di, tri,... Ví dụ: isobutyl vẫn ưu tiên hơn dimethyl, mặc dù “i” đứng sau “d”.
Lời giải chi tiết:
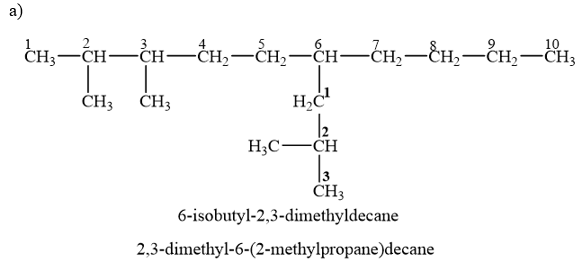
12.20
Chỉ số octane (octane number) là đại lượng đặc trưng cho yếu tố đo lường khả năng chống kích nổ của một nhiên liệu khi nhiên liệu này bốc cháy với không khí bên trong xi lanh của động cơ đốt trong. Nếu chỉ số octane của một mẫu xăng thấp, xăng sẽ tự cháy mà không do bu-gi bật tia lửa điện đốt. Điều này làm cho hiệu suất động cơ giảm và sẽ hư hao các chi tiết máy.
Người ta quy ước rằng chỉ số octane của 2,2,4-trimethylpentane là 100 và của heptane là 0. Các hydrocarbon mạch vòng và mạch phân nhánh có chỉ số octane cao hơn hydrocarbon mạch không phân nhánh.
Để xác định chỉ số octane của một mẫu xăng, người ta dùng máy đo chỉ số octane.
a) Chỉ số octane càng cao, chất lượng xăng sẽ như thế nào?
b) Trong thực tế, xăng không chỉ gồm 2,2,4-trimethylpentane và heptane mà là một hỗn hợp gồm nhiều hydrocarbon khác nhau. Giả thiết một mẫu xăng chỉ gồm 8 phần thể tích 2,2,4-trimethylpentane và 2 phần thể tích heptane thì chỉ số octane của mẫu xăng này là bao nhiêu?
Phương pháp giải:
Xăng dầu có chỉ số octane càng cao thì càng có hiệu suất cháy cao.
Chỉ số octane của 2,2,4-trimethylpentane là 100. Giả sử mẫu xăng có a% phần thể tích là 2,2,4-trimethylpentane thì mẫu xăng này có chỉ số octane là a.
Lời giải chi tiết:
a) Chỉ số octane càng cao, độ chịu nén trước khi phát nổ của xăng càng lớn nên chất lượng xăng càng tốt. Ví dụ xăng có chỉ số octane 92 dễ bị cháy khi nén hơn so với xăng có chỉ số octane 95 nên xăng có chỉ số octane 95 giá trị hơn xăng có chỉ số octane 92. Tuy nhiên phải tuỳ vào tỉ số nén của động cơ để chọn xăng phù hợp. Động cơ có tỉ số nén thấp thì không cần dùng xăng có chỉ số octane cao.
b) Vì mẫu xăng trên chứa 80% thể tích là 2,2,4-trimethylpentane, nên chỉ số octane của mẫu xăng là 80.
12.21
Ethanol có thể làm tăng chỉ số octane của xăng không?
Phương pháp giải:
Chỉ số octane (octane number) là đại lượng đặc trưng cho yếu tố đo lường khả năng chống kích nổ của một nhiên liệu khi nhiên liệu này bốc cháy với không khí bên trong xi lanh của động cơ đốt trong.
Lời giải chi tiết:
Chỉ số octane là thước đo khả năng chống kích nổ của xăng. Ethanol có cấu trúc phân tử gồm các nguyên tử carbon và hydrogen liên kết đơn giản với nhau. Do đó ethanol có thể cháy ổn định hơn so với các phân tử xăng phức tạp khác. Ethanol có chỉ số octane cao hơn nhiều (khoảng 109) so với xăng. Khi trộn ethanol vào xăng với tỷ lệ nhất định, chỉ số octane trung bình của hỗn hợp sẽ được nâng lên, giúp xăng cháy ổn định và hiệu quả hơn trong động cơ.
12.22
Thế nào là xăng RON 92? RON 95? Xăng nào có chỉ số octane cao hơn?
Phương pháp giải:
RON là viết tắt của Research Octane Number, tức chỉ số octane nghiên cứu.
Lời giải chi tiết:
Xăng RON 92 là xăng có chỉ số octane 92.
Xăng RON 95 là xăng có chỉ số octane 95.
Do đó, xăng RON 95 có chỉ số octane cao hơn so với xăng RON 92.
12.23
Tính chỉ số octane của xăng E5 và xăng E10.
Phương pháp giải:
Xăng E5 chứa 5% ethanol và 95% xăng RON 92 (theo thể tích).
Xăng E10 chứa 10% ethanol và 90% xăng RON 92 (theo thể tích).
Chỉ số octane của ethanol và xăng RON 92 lần lượt là 109 và 92.
Lời giải chi tiết:
Xăng E5 chứa 5% ethanol và 95% xăng RON 92 (theo thể tích).
\[ \Rightarrow \]Chỉ số octane của xăng E5 là: \[\frac{{5 \times 109 + 95 \times 92}}{{100}} = 92,85\]
Xăng E10 chứa 10% ethanol và 90% xăng RON 92 (theo thể tích).
\[ \Rightarrow \ ]Chỉ số octane của xăng E10 là:
\[\frac{{10 \times 109 + 90 \times 92}}{{100}} = 93,7\]