Bài Ôn tập chương 5 trang 87, 88, 89, 90 SBT Hóa 11 Chân trời sáng tạo
Trong số các chất sau, chất tan trong nước ở điều kiện thường là
BT 1
Trong số các chất sau, chất tan trong nước ở điều kiện thường là
A. C 2 H 5 OH. B. C 2 H 5 Cl. C. C 6 H 5 OH. D. C 6 H 5 Cl.
Phương pháp giải:
- Alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng
- Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.
- Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol.
Lời giải chi tiết:
Ở điều kiện thường:
+ C 2 H 5 OH tan tốt trong nước.
+ Hai dẫn xuất halogen: C 2 H 5 Cl và C 6 H 5 Cl không tan trong nước.
+ Phenol (C 6 H 5 OH) ít tan trong nước.
→ Chọn A .
BT 2
Chất dùng để nhận biết hai chất lỏng phenol với ethanol là
A. quỳ tím. B. nước nóng. C. nước bromine. D. dung dịch NaOH.
Phương pháp giải:
Phenol phản ứng bromine tạo kết tủa trắng 2,4,6-tribromophenol.
Ethanol không phản ứng với bromine.
Lời giải chi tiết:
Để nhận biết 2 chất lỏng phenol và ethanol, có thể dùng dung dịch Br 2 .
Phenol phản ứng với dung dịch Br 2 tạo kết tủa trắng.
Ethanol không phản ứng với dung dịch Br 2 .
→ Chọn C .
BT 3
Dẫn xuất halogen nào sau đây khi tác dụng với NaOH không tạo thành alcohol?
A. C 2 H 5 Cl. B. C 6 H 5 CH 2 Br. C. C 6 H 5 Cl. D. CH 3 CH(Br)CH 3 .
Phương pháp giải:
Đun dẫn xuất halogen (R-X, trong đó, X liên kết với nguyên tử C no) với dung dịch kiềm, thu được alcohol (R-OH).
Với X là các halogen Cl, Br, I. Phản ứng này còn được gọi là phản ứng thuỷ phân dẫn xuất halogen.
Lời giải chi tiết:
Các dẫn xuất halogen tác dụng với NaOH tạo thành alcohol: C 2 H 5 Cl, C 6 H 5 CH 2 Br, CH 3 CH(Br)CH 3 .
C 6 H 5 Cl khi tác dụng với NaOH thu được muối sodium phenolate:
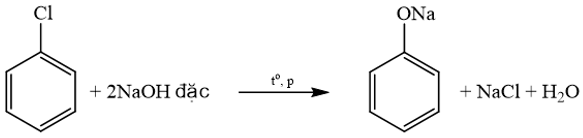
→ Chọn C .
BT 4
Phát biểu nào sau đây không đúng?
A. Phenol có nhiệt độ sôi cao hơn và độ tan trong nước kém hơn ethanol.
B. Dẫn xuất halogen của hydrocarbon không tan trong nước lạnh, tan nhiều trong nước ở 66 °C.
C. Theo chiều tăng phân tử khối, nhiệt độ sôi của các dẫn xuất halogen tăng từ F đến I.
D. Độ tan của các alcohol có cùng số nhóm –OH giảm khi mạch carbon tăng.
Phương pháp giải:
- Phenol có nhiệt độ sôi (181,8 o C) cao hơn ethanol (78,3 o C). Phenol ít tan trong nước lạnh, ethanol tan vô hạn trong nước.
- Dẫn xuất halogen của hydrocarbon không tan trong nước.
- Nhiệt độ sôi của các dẫn xuất halogen tăng theo chiều tăng nguyên tử khối của halogen từ F, Cl, Br, I (cùng gốc alkyl).
- Alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng.
Lời giải chi tiết:
Phát biểu B sai vì xuất halogen của hydrocarbon không tan trong nước
→ Chọn B .
BT 5
Cho các chất: C 2 H 5 OH, C 2 H 5 Br, C 6 H 5 OH, C 6 H 5 CH 2 OH, C 6 H 5 Cl. Số chất tác dụng được với dung dịch NaOH loãng khi đun nóng là
A. 4. B. 5. C. 3. D. 2.
Phương pháp giải:
Phenol và dẫn xuất halogen (R-X, trong đó, X liên kết với nguyên tử C no) phản ứng với dung dịch NaOH loãng khi đun nóng.
Alcohol không phản ứng với dung dịch NaOH.
Lời giải chi tiết:
Các alcohol: C 2 H 5 OH, C 6 H 5 CH 2 OH không tác dụng với NaOH.
C 6 H 5 Cl phản ứng với NaOH đặc, không tác dụng với dung dịch NaOH loãng.
Các chất tác dụng được với dung dịch NaOH loãng khi đun nóng là C 2 H 5 Br, C 6 H 5 OH.
→ Chọn D .
BT 6
Xác nhận đúng hoặc sai cho các phát biểu trong bằng sau:
|
STT |
Phát biểu |
Đúng/sai |
|
1 |
Các dẫn xuất halogen đều chứa nguyên tử carbon, hydrogen và halogen trong phân tử. |
? |
|
2 |
Alcohol là hợp chất hữu có nhóm -OH liên kết trực tiếp với nguyên tử carbon. |
? |
|
3 |
|
? |
|
4 |
Các dẫn xuất halogen rất ít tan trong nước. |
? |
|
5 |
Các halogenoalkane và alkanol tham gia phản ứng tách để tạo ra alkene. |
? |
|
6 |
Phenol tham gia phản ứng thế (thế halogen, thế nitro, ...) dễ hơn benzene. |
? |
|
7 |
Các alcohol tạo được liên kết hydrogen với các phân tử nước nên nhiệt độ sôi của alcohol tương đối cao. |
? |
Phương pháp giải:
1. Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng một hay nhiều nguyên tử halogen, ta được dẫn xuất halogen của hydrocarbon.
2. Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no.
3. Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
4. Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.
5. Các dẫn xuất halogenoalkane có thể bị tách hydrogen halide để tạo thành alkene. Các alkanol có phản ứng tách nước tạo alkene.
6. Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene).
7. Giữa các phân tử ethanol có liên kết hydrogen liên phân tử nên nhiệt độ sôi của alcohol tương đối cao.
Lời giải chi tiết:
1. Các dẫn xuất halogen đều chứa nguyên tử carbon, hydrogen và halogen trong phân tử.
→ Sai. Các dẫn xuất halogen đều chứa carbon và halogen trong phân tử, không nhất thiết phải có hydrogen. Ví dụ như CCl 4 .
2. Alcohol là hợp chất hữu có nhóm -OH liên kết trực tiếp với nguyên tử carbon.
→ Sai. Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no .
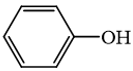
3.
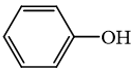 là hợp chất không thuộc loại alcohol.
là hợp chất không thuộc loại alcohol.
→ Đúng. Hợp chất này là phenol, không phải là alcohol vì alcohol có nhóm –OH liên kết trực tiếp với carbon no.
4. Các dẫn xuất halogen rất ít tan trong nước.
→ Đúng. Dẫn xuất halogen không tan trong nước nhưng tan trong các dung môi hữu cơ như alcohol, ether, benzene.
5. Các halogenoalkane và alkanol tham gia phản ứng tách để tạo ra alkene.
→ Sai. Các dẫn xuất halogenoalkane bị tách hydrogen halide để tạo thành alkene. Các alkanol tách nước tạo alkene. Các halogenoalkane không phản ứng với alkanol để tạo ra alkene.
6. Phenol tham gia phản ứng thế (thế halogen, thế nitro, ...) dễ hơn benzene.
→ Đúng. Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen (thế halogen, thế nitro, ...) trong vòng benzene của phenol.
7. Các alcohol tạo được liên kết hydrogen với các phân tử nước nên nhiệt độ sôi của alcohol tương đối cao.
→ Sai. Các alcohol tạo được liên kết hydrogen liên phân tử nên nhiệt độ sôi của alcohol tương đối cao.
|
STT |
Phát biểu |
Đúng/sai |
|
1 |
Các dẫn xuất halogen đều chứa nguyên tử carbon, hydrogen và halogen trong phân tử. |
Sai |
|
2 |
Alcohol là hợp chất hữu có nhóm -OH liên kết trực tiếp với nguyên tử carbon. |
Sai |
|
3 |
|
Đúng |
|
4 |
Các dẫn xuất halogen rất ít tan trong nước. |
Đúng |
|
5 |
Các halogenoalkane và alkanol tham gia phản ứng tách để tạo ra alkene. |
Sai |
|
6 |
Phenol tham gia phản ứng thế (thế halogen, thế nitro, ...) dễ hơn benzene. |
Đúng |
|
7 |
Các alcohol tạo được liên kết hydrogen với các phân tử nước nên nhiệt độ sôi của alcohol tương đối cao. |
Sai |
BT 7
Nghiên cứu số liệu về năng lượng liên kết, độ dài liên kết và độ phân cực carbon – halogen, cho biết khả năng phản ứng thế nguyên tử halogen bằng nhóm –OH thay đổi như thế nào từ CH 3 F đến CH 3 I. Nêu sự tương quan giữa các giá trị và độ phân cực của các chất.
Năng lượng và độ dài liên kết carbon – halogen
|
Đặc điểm |
C-F |
C-Cl |
C-Br |
C-I |
|
Năng lượng liên kết (kJ/mol) |
453 |
339 |
276 |
216 |
|
Độ dài liên kết (pm) |
133 |
177 |
194 |
213 |

Phương pháp giải:
Năng lượng liên kết C−X lớn, độ dài liên kết C−X giảm, độ bền liên kết C−X tăng.
Lời giải chi tiết:
Năng lượng liên kết C−X lớn, độ dài liên kết C−X giảm, độ bền liên kết C−X tăng. Theo chiều từ liên kết C–F đến C−I, năng lượng liên kết giảm dần, độ dài liên kết tăng, đồng thời sự phân cực giảm nên khả năng thế nhóm -OH tăng theo chiều: C−F < C-Cl < C–Br < C-I
BT 8
Kí hiệu (A), (B), (C) và (D) cho các chất không theo trình tự: C 6 H 5 OH, CH 3 OH, C 2 H 5 I, C 2 H 4 (OH) 2 có các thông tin như sau:
|
Chất |
Nhiệt độ sôi ( o C) |
Độ tan trong nước tại 25 o C |
|
(A) |
72,0 |
- |
|
(B) |
64,7 |
∞ |
|
(C) |
198,0 |
∞ |
|
(D) |
182,0 |
0,895 (mol/L) |
Lập luận để xác định công thức của các chất (A), (B), (C) và (D).
Phương pháp giải:
Do tạo được liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng. Alcohol đa chức có nhiệt độ sôi cao hơn so với các alcohol đơn chức có khối lượng tương đương vì chúng tạo được nhiều liên kết hydrogen liên phân tử hơn.
Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương. Phenol tan ít trong nước lạnh.
Dẫn xuất halogen của hydrocarbon không tan trong nước.
Lời giải chi tiết:
Chất (A) không tan trong nước, do đó (A) là C 2 H 5 l.
Chất (B) và (C) tan vô hạn trong nước, do đó (B) và (C) là alcohol, mà (B) có nhiệt độ sôi thấp hơn (C). Do đó (B) là C 2 H 5 OH; (C) là C 2 H 4 (OH) 2 .
Chất (D) tan ít trong nước lạnh, do đó (D) là phenol (C 6 H 5 OH).
Vậy (A) là C 2 H 5 l; (B) là C 2 H 5 OH; (C) là C 2 H 4 (OH) 2 ; (D) là C 6 H 5 OH.
BT 9
Độ alcohol hay độ cồn là giá trị cho biết thể tích alcohol có trong dung dịch. Độ cồn được tính theo số mL alcohol có trong 100 mL dung dịch ở 20 °C. Một loại nước uống có cồn, thể tích bình chứa 330 mL dung dịch và trên nhãn ghi độ cồn là 4,5°.
a) Tính thể tích ethanol có trong 330 mL dung dịch của loại nước uống này.
b) Tính khối lượng của ethanol có trong 330 mL dung dịch (khối lượng riêng của ethanol 0,789 g/mL).
c) Một số poster tuyên truyền về LD 50 của ethanol bằng cách quy đổi khối lượng ethanol về số lượng cốc rượu, bia hoặc đơn vị lon, chai, ... uống vào cơ thể. LD 50 của ethanol đối với người trưởng thành là 5 gam – 8 gam. Khi thiết kế poster, cần vẽ bao nhiêu đơn vị bình chứa để thể hiện giá trị LD 50 của ethanol cho một người trưởng thành có cân nặng trung bình 60 kg.
Phương pháp giải:
\[{\rm{a) }}{{\rm{V}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {{\rm{V}}_{{\rm{dd}}}} \times \frac{{{{\rm{a}}^{\rm{o}}}}}{{{\rm{100}}}}\]
Với a là độ cồn. Thể tích được tính theo đơn vị mL.
b) \[{{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {{\rm{V}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} \times {{\rm{D}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}}\]
c) Tính khối lượng ethanol gây ra tình trạng nguy kịch cho sức khoẻ (m).
Số bình chứa: \[\frac{{{{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}}}}{{\rm{m}}}\]
Lời giải chi tiết:
a) Thể tích ethanol có trong 330 mL dung dịch: \({{\rm{V}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {\rm{330}} \times \frac{{4,5}}{{{\rm{100}}}} = 14,85{\rm{ }}({\rm{mL}})\)
b) Khối lượng của ethanol có trong 330 mL dung dịch:
\({{\rm{m}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = {{\rm{V}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} \times {{\rm{D}}_{{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH}}}} = 14,85 \times 0,789 \approx 11,72{\rm{ }}({\rm{g}})\)
c) LD 50 của ethanol đối với người trưởng thành trong khoảng 5 gam – 8 gam trên 1 kg trọng lượng cơ thể.
Trung bình, một người trưởng thành nặng 60 kg, khi sử dụng đồ uống có cồn, lượng ethanol có thể gây ra tình trạng nguy kịch cho sức khoẻ là: \(5 \times 60 = 300{\rm{ (g)}}\)
Mỗi bình 330 mL chứa 11,72 gam ethanol.
Do đó, với 300 gam ethanol cần số bình chứa: \(\frac{{300}}{{11,72}} \approx 26\) (bình chứa)
BT 10
Nhiệt độ sôi của một số hợp chất được thể hiện trong biểu đồ bên dưới:
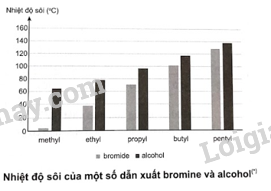
a) Nhận xét sự biến thiên nhiệt độ sôi của các hợp chất trong biểu đồ trên theo chiều tăng gốc alkyl và giải thích.
b) Vì sao nhiệt độ sôi của ethanol cao hơn bromoethane (ethyl bromide)?
Phương pháp giải:
a) Tương tác Van der Waals giữa các phân tử tăng theo chiều tăng của phân tử khối.
b) Alcohol tạo được liên kết hydrogen liên phân tử ,do đó nhiệt độ sôi của alcohol cao hơn dẫn xuất halogen có cùng số C.
Lời giải chi tiết:
a) Theo chiều tăng gốc alkyl, từ methyl đến pentyl, nhiệt độ sôi của các dẫn xuất bromide và alcohol tăng dần. Nguyên nhân là do sự tăng tương tác Van der Waals giữa các phân tử.
b) Nhiệt độ sôi của ethanol cao hơn bromoethane (ethyl bromide) là do giữa các phân tử alcohol hình thành liên kết hydrogen.
BT 11
Hợp chất hữu cơ (X) chứa vòng benzene, cho thông tin về phổ IR và MS của hợp chất (X) như sau:
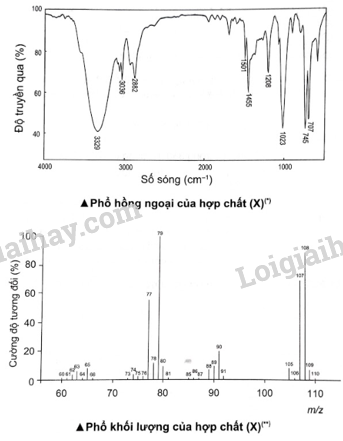
Biện luận để xác định cấu tạo phân tử hợp chất hữu cơ (X).
Phương pháp giải:
Trên phổ hồng ngoại, xác định các peak đặc trưng của nhóm –OH, C–O.
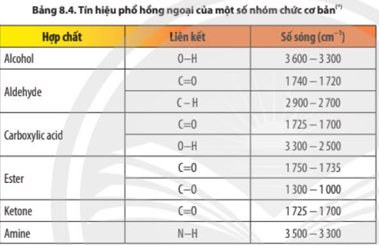
Trên phổ khối lượng, xác định phân tử khối thông qua tín hiệu m/z lớn nhất.
Lời giải chi tiết:
* Trong phổ IR
– Hợp chất hữu cơ (X) có vòng benzene, có thể là gốc phenyl (C 6 H 5 -) hoặc –C 6 H 4 −, ..
– Tín hiệu mạnh ở số sóng 3 329 cm -1 , đặc trưng cho nhóm –OHX là phenol hoặc alcohol.
− Tín hiệu ở số sóng 1 023 cm -1 , đặc trưng cho C–O alcohol (C–O phenol thường nằm trong vùng 1 260 − 1 200 cm -1 ).
* Trong phổ MS:
– Tín hiệu có m/z = 77, C 6 H 5 –
- Tín hiệu có m/z = 108 Công thức phân tử và công thức cấu tạo của (X) lần lượt là C 7 H 8 O và C 6 H 5 –CH 2 –OH.
Các tín hiệu mạnh còn lại có thể là hợp chất trung gian

 là hợp chất không thuộc loại alcohol.
là hợp chất không thuộc loại alcohol.
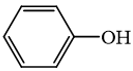 là hợp chất không thuộc loại alcohol.
là hợp chất không thuộc loại alcohol.