Bài 6. Sulfur và sulfur dioxide trang 20, 21, 22 SBT Hóa 11 Cánh diều
Những phát biểu nào sau đây là đúng?
6.1
Những phát biểu nào sau đây là đúng?
(a) Trong tự nhiên, sulfur tồn tại chủ yếu ở dạng muối sulfide và muối sulfate của một số kim loại.
(b) Là một phi kim khá hoạt động nên trong tự nhiên không tìm thấy sulfur đơn chất.
(c) Trứng gà ung có mùi thối đặc trưng một phần là do các hợp chất của sulfur có trong trứng phân huỷ gây ra.
(d) Nguyên tố sulfur có mặt trong một số loại thực vật, đặc biệt là các loại rau quả có mùi mạnh như hành tây, sầu riêng,...
(e) Thành phần chính của quặng pyrite là hợp chất của sulfur và chì (lead, Pb).
Phương pháp giải:
Dựa vào đặc điểm, trạng thái tự nhiên và tính chất vật lí của sulfur
Lời giải chi tiết:
Các phát biểu đúng: (a), (c) và (d).
b) Sai. Trong tự nhiên sulfur tồn tại cả ở dạng đơn chất và hợp chất.
e) Sai. Thành phần chính của quặng pyrite là hợp chất của sulfur và sắt (Fe).
6.2
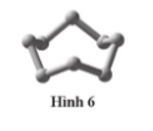
Phân tử sulfur, S 8 , có cấu tạo như Hình 6.
a) Giải thích vì sao phân tử này không phân cực.
b) Những phát biểu nào dưới đây là phù hợp với tính không phân cực của sulfur
(b1) Hầu như không tan trong nước.
 (b2) Tan nhiều trong dung môi ethanol.
(b3) Tan tốt trong dung môi không phân cực như carbon disulfide (CS
2
).
(b4) Có tính sát khuẩn.
(b2) Tan nhiều trong dung môi ethanol.
(b3) Tan tốt trong dung môi không phân cực như carbon disulfide (CS
2
).
(b4) Có tính sát khuẩn.
Phương pháp giải:
Dựa vào đặc điểm, trạng thái tự nhiên và tính chất vật lí của sulfur
Lời giải chi tiết:
a) Các liên kết S–S trong S, đều là liên kết cộng hoá trị không cực nên hợp chất S 8 cũng là hợp chất không phân cực.
b) Phát biểu phù hợp:
(b1) Nước là dung môi phân cực nên không thể hòa tan sulfur. ĐÚNG
(b2) Dung môi không phân cực có khả năng hòa tan sulfur. ĐÚNG
6.3
Thành phần chính của khí thiên nhiên là các hydrocarbon như methane (khoảng 80 - 85%), ethane, propane, butane cùng lượng nhỏ các khí carbon dioxide, hydrogen sulfide, nitrogen. Thành phần chính của than là carbon, ngoài ra còn có một số hợp chất của các nguyên tố H, S, O, N,...
Khi sử dụng khí thiên nhiên hoặc than làm nhiên liệu đều thải vào không khí các chất khí gây ô nhiễm. Giải thích.
Phương pháp giải:
Dựa vào đặc điểm, trạng thái tự nhiên và tính chất vật lí của sulfur
Lời giải chi tiết:
Khí thiên nhiên và than khi cháy sẽ tỏa rất nhiều nhiệt, tạo điều kiện cho các hợp chất như hydrogen sulfide và các hợp chất chứa S, N bị oxi hoá sinh ra các khí độc gây ô nhiễm như SO 2 , NO, NO 2 ,..., các khí này là nguyên nhân gây mưa acid.
6.4
Những ý kiến nào sau đây về sulfur dioxide (SO 2 ) là đúng?
(a) Có độc tính đối với con người.
(b) Phản ứng được với đá vôi.
(c) Khí này được tạo thành từ hoạt động của núi lửa trong tự nhiên, từ quá trình đốt cháy nhiên liệu hóa thạch của con người,...
(d) Là oxide lưỡng tính.
Phương pháp giải:
Dựa vào tính chất hóa học của SO2
Lời giải chi tiết:
a) Đúng. Sulfur có độc với con người
b) Đúng. Sulfur dioxide phản ứng với đá vôi theo phương trình:
CaCO 3 (s) + SO 2 (g) → CaSO 3 (s) + CO 2 (g)
c) Đúng. Thành phần chính của than là carbon, ngoài ra còn có một số hợp chất của các nguyên tố H, S, O, N,...Khi sử dụng khí thiên nhiên hoặc than làm nhiên liệu đều thải vào không khí các chất khí gây ô nhiễm.
d) Sai. Sulfur dioxide là oxide acid.
6.5
Nối những đặc điểm của chất ở cột B với tên chất ở cột A cho phù hợp.
|
Cột A |
Cột B |
|
a) Sulfur |
1. Là chất khí ở điều kiện thường. |
|
2. Ở điều kiện thường, phân tử có 8 nguyên tử. |
|
|
3. Dễ tan trong nước. |
|
|
b) Sulfur dioxide |
4. Hoà tan trong dung môi phù hợp để làm thuốc trị bệnh ngoài da. |
|
5. Dùng để tẩy trắng vải, sợi. |
|
|
6. Có tính khử và tính oxi hoá. |
Phương pháp giải:
Dựa vào đặc điểm, trạng thái tự nhiên và tính chất vật lí của sulfur
Lời giải chi tiết:
a) – 2,4,6
b) – 1,3,5
6.6
Trong phản ứng, SO 2 có thể đóng vai trò là một oxide acid (acidic oxide). Hoàn thành các phương trình hoá học dưới đây để minh họa vai trò oxide acid của SO 2 .
a) Tan trong nước tạo thành acid yếu H 2 SO 3 .
b) Phản ứng với dung dịch base tạo muối và nước.
c) Phản ứng với oxide base (basic oxide) tạo muối.
Phương pháp giải:
Dựa vào tính chất hóa học của SO2
Lời giải chi tiết:
a) SO 2 + H 2 O ⇌ H 2 SO 3
b) SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
c) SO 2 + CaO → CaSO 3
6.7
Cho giá trị enthalpy tạo thành chuẩn của khí SO 2 và khí SO 3 lần lượt là –296,8 kJ mol − 1 và –395,7 kJ mol − 1 .
Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau:
SO 2 (g) + \(\frac{1}{2}\)O 2 (g) → SO 3 (g)
Từ đó, hãy cho biết phản ứng trên có thuận lợi về mặt năng lượng không.
Phương pháp giải:
Dựa vào tính chất hóa học của SO2
Lời giải chi tiết:
Δ r H o 298 = Δ f H o 298 (SO 3 ) – Δ f H o 298 (SO 2 ) = (-395,7) - (-296,8) = -98,9 (kJ)
Giá trị biến thiên enthalpy chuẩn của phản ứng có giá trị âm, tức phản ứng toả nhiệt nên thuận lợi về mặt năng lượng.
6.8
: Một số quá trình tự nhiên và hoạt động của con người thải hydrogen sulfide vào không khí. Chất này có thể bị oxi hoá bởi oxygen có trong không khí theo hai phản ứng sau:
H 2 S(g) + \(\frac{3}{2}\)O 2 (g) → SO 2 (g) + H 2 O(g) (1)
H 2 S(g) +\(\frac{1}{2}\) O 2 (g) → S(s) + H 2 O(g) (2)
Cho biết giá trị enthalpy tạo thành chuẩn của H 2 S(g), SO 2 (g) và H 2 O(g) lần lượt là: –20,7 kJ mol − 1 ; –296,8 kJ mol − 1 và –241,8 kJ mol − 1 .
Phương pháp giải:
Dựa vào tính chất hóa học của SO2
Lời giải chi tiết:
(1) Δ r H o 298 = Δ f H o 298 (SO 2 ) + Δ f H o 298 (H 2 O) - Δ f H o 298 (H 2 S)
= (-296,8) + (-241,8) - (-20,7) = -517,9 kJ
(2) Δ r H o 298 = Δ f H o 298 (H 2 O) – Δ f H o 298 (H 2 S)
= (-241,8) - (-20,7) = -221,1 kJ
Cả hai phản ứng đều thuận lợi về mặt năng lượng vì giá trị biến thiên enthalpy chuẩn của hai phản ứng đều âm
b) Hydrogen sulfide sẽ dễ chuyển thành sulfur theo phản ứng (2), vì phản ứng (2) cần ít oxygen hơn so với phản ứng (1).
6.9
Bột đá vôi có thể được sử dụng để xử lí khí thải chứa sulfur dioxide từ các nhà máy điện đốt than và dầu mỏ. Phương trình hoá học của phản ứng là:
CaCO 3 (s) + SO 2 (g) → CaSO 3 (s) + CO 2 (g)
a) Vì sao phản ứng trên được gọi là phản ứng khử sulfur trong khí thải?
b) Tính giá trị biến thiên enthalpy chuẩn của phản ứng trên theo số liệu giá trị enthalpy tạo thành chuẩn của các hợp chất trong bảng sau đây. Cho biết phản ứng có thuận lợi về mặt năng lượng không.
|
Hợp chất |
CaSO 3 (s) |
CaCO 3 (s) |
SO 2 (g) |
CO 2 (g) |
|
Δ f H o 298 |
- 1634,9 |
- 1207,6 |
- 296,8 |
- 393,5 |
c) Trong phản ứng trên, vì sao đá vôi phải được dùng ở dạng bột?
d) Calcium sulfite (CaSO 3 ) thường được chuyển hoá thành thạch cao có công thức CaSO 4 .2H 2 O. Phản ứng hoá học chuyển CaSO 3 thành CaSO 4 .2H 2 O có thuộc loại phản ứng oxi hoá – khử không?
Phương pháp giải:
Dựa vào tính chất hóa học của SO2
Lời giải chi tiết:
a) Vì S trong khí thải (SO 2 ) được thay thế bằng C (trong CO2).
b) Δ r H o 298 = Δ f H o 298 (CO 2 ) + Δ f H o 298 (CaSO 3 ) - Δ f H o 298 (SO 2 ) - Δ f H o 298 (CaCO 3 )
= (-393,5) + (-1634,9) - (-296,8) - (-1207,6) = –524,0 kJ.
Phản ứng toả nhiệt nên thuận lợi về năng lượng.
c) Để tăng diện tích tiếp xúc giữa calcium carbonate với khí nhằm tăng tốc độ phản ứng.
d) Là phản ứng oxi hoá khử vì làm tăng số oxi hóa của sulfur từ +4 (trong CaSO 3 ) lên +6 (trong CaSO 4 ).