Bài 12. Điện phân trang 41, 42 SBT Hóa 12 Cánh diều
Điền từ hoặc cụm từ thích hợp vào chỗ trống trong các câu sau:
12.1
Điền từ hoặc cụm từ thích hợp vào chỗ trống trong các câu sau:
a) Điện phân là quá trình ...(1)... xảy ra trên bề mặt các điện cực dưới tác dụng của ...(2)... đi qua dung dịch chất điện li hoặc chất điện li nóng chảy.
b) Trong quá trình điện phân, ở cực âm, chất nào có tính oxi hoá ...(1)... được ưu tiên điện phân trước. Ở cực dương, chất nào có tính khử ...(2)... được ưu tiên điện phân trước. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn, như sản xuất kim loại ...(3)..., mạ điện, ...(4)....
Phương pháp giải:
Dựa vào khái niệm điện phân.
Lời giải chi tiết:
a) (1) oxi hóa khử (2) dòng điện 1 chiều
b) (1) mạnh hơn ( 2) mạnh hơn (3) mạnh (Na, Al…..) (4) tinh chế kim loại
12.2
Phát biểu nào sau đây về thứ tự điện phân trong dung dịch của các ion kim loại ở điện cực là đúng?
A . Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực âm.
B. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực âm.
C. Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực dương.
D. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực dương.
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực âm.
Đáp án A
12.3
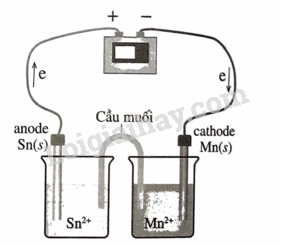
Vẽ một bình điện phân trong đó Mn 2+ bị khử thành Mn và Sn bị oxi hoá thành Sn 2+ . Ghi nhãn cho cực dương và cực âm, chỉ ra hướng chuyển động của các electron và viết phương trình hoá học xảy ra ở mỗi điện cực. Điện áp tối thiểu cần thiết để xảy ra sự điện phân là bao nhiêu? Biết \(E_{M{n^{2 + }}/Mn}^0 = - 1,{18_{}}V\).
Phương pháp giải:
Dựa vào quá trình xảy ra trong điện phân dung dịch.
Lời giải chi tiết:
Vì Mn 2+ bị khử thành Mn nên Mn là cathode (cực âm của bình điện phân):
\(M{n^{2 + }} \to Mn + 2{\rm{e}}\) \(E_{M{n^{2 + }}/Mn}^o = - 1,18V\)
Sn bị oxi hóa thành Sn 2+ nên Sn là anode (cực dương của bình điện phân:
\(Sn \to S{n^{2 + }} + 2{e_{}}{^{}_{}}E_{S{n^{2 + }}/Sn}^0 = - 0,138V\)
Phản ứng xảy ra trong bình điện phân ngược với phản ứng tự xảy ra trong pin điện nên
E = E cathode – E anode = -1,18 V – (-0,138 V) = -1,042 V.
Vậy điện áp tối thiểu để quá trình điện phân xảy ra là 1,042 V
12.4
Khi điện phân dung dịch NaCl có màng ngăn, các chất được tạo ra ở anode (cực dương) và cathode (cực âm) lần lượt là
A . Cl 2 và NaOH, H 2 . B. Na và Cl 2 . C. Cl 2 và Na. D. NaOH và H 2 .
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
ở anode xảy ra quá trình oxi hóa Cl - tạo khí Cl 2
ở cathode xảy ra quá trình khử H 2 O.
Cl 2 và NaOH, H 2 .
Đáp án A
12.5
Điện phân dung dịch hỗn hợp gồm \({\rm{HCl}}\) và \({\rm{CuS}}{{\rm{O}}_4}\) có cùng nồng độ. Các chất được tạo ra đầu tiên ở anode (cực dương) và ở cathode (cực âm) lần lượt là:
A. \({\rm{C}}{{\rm{l}}_2}\) và \({{\rm{H}}_2}\). B. \({\rm{C}}{{\rm{l}}_2}\) và \({\rm{Cu}}\). C. \({{\rm{O}}_2}\) và \({\rm{Cu}}\). D. \({{\rm{O}}_2}\) và \({{\rm{H}}_2}\).
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch
Lời giải chi tiết:
Ở cực cathode diễn ra quá trình khử Cu 2+ thành Cu.
Ở cực anode diễn ra quá trình oxi hóa Cl - thành Cl 2
Đáp án B
12.6
Điện phân dung dịch \({\rm{NaCl}}\) có màng ngăn với cường độ dòng điện \(10\;{\rm{A}}\) trong 2 giờ. Tính khối lượng dung dịch giảm sau khi điện phân, giả thiết chỉ có phản ứng điện phân dung dịch \({\rm{NaCl}}\), bỏ qua lượng nước bay hơi. Cho biết các công thức:
\({\rm{Q}} = {\rm{n}}.{\rm{F}} = {\rm{I}}.{\rm{t}}\), trong đó: \({\rm{Q}}\) là điện lượng \(({\rm{C}}),{\rm{n}}\) là số mol electron đi qua dây dẫn, \({\rm{I}}\) là cường độ dòng điện \({\rm{A}}),{\rm{t}}\) là thời gian (giây), \({\rm{F}}\) là hằng số Faraday \(\left( {96500{\rm{Cmo}}{{\rm{l}}^{ - 1}}} \right)\).
Phương pháp giải:
Dựa vào công thức đề bài cung cấp.
Lời giải chi tiết:
\(NaC{l_{\left( {aq} \right)}} \to N{a^ + }_{\left( {aq} \right)} + C{l_{\left( {aq} \right)}}^ - \)
Số mol electron trao đổi tại các điện cực \({{\rm{n}}_{\rm{e}}} = \frac{{{\rm{It}}}}{{\rm{F}}} = \frac{{10.3600.2}}{{96500}} = 0,746(\;{\rm{mol}})\).

Khối lượng dung dịch giảm là do \({\rm{C}}{{\rm{l}}_2}\) và \({{\rm{H}}_2}\) bay hơi.
Khối lượng dung dịch giảm là \(0,373.(2 + 70) = 26,856(\;{\rm{g}})\)
12.7
Một loại quặng nhôm có chứa 40% khối lượng Al.
a) Nhôm trong loại quặng trên ở dạng Al 2 O 3 , hỏi quặng trên chứa bao nhiêu phần trăm tạp chất.
b) Để điện phân toàn bộ lượng Al 2 O 3 nóng chảy thu được từ 1000 kg loại quặng trên bởi dòng điện một chiều có cường độ 10000 A thì về lí thuyết cần bao nhiêu giờ điện phân liên tục? Cho biết số mol electron n đi qua dây dẫn được tính theo công thức n = (I.t)/F.
Trong đó, I là cường độ dòng điện (A), t là thời gian (s), F là số Faraday (96500 C.mol -1 ).
Phương pháp giải:
Dựa vào công thức đề bài cung cấp.
Lời giải chi tiết:
Khối lượng Al có trong 1000kg quặng là 400kg tương ứng với khối lượng Al 2 O 3 là\(\frac{{400}}{{27.2}}.102 = 755,56kg\)
Vậy phần trăm tạp chất trong loại quặng trên là
\(\frac{{1000 - 755,56}}{{1000}}.100\% = 24,4\% \)
b. Số mol Al trong 1000kg quặng trên là
\(\frac{{{{10}^3}{{.10}^3}}}{{27}}.40\% = 14815\,mol\)
Số mol electron cần cho quá trình điện phân là
3.14815=44445 mol vì \(A{l^3}^ + + 3e \to 3Al\)
Áp dụng công thức tính được t = 119,14 giờ
12.8
Khi điện phân dung dịch CuSO 4 , ion nào sẽ điện phân đầu tiên ở cathode?
A. Cu 2+ . B. H + (của nước). C. SO 4 2- . D. OH - (của nước).
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Ở cathode có thể xảy ra sự khử ion Cu 2+ hoặc H 2 O. Tuy nhiên, ion Cu 2+ dễ bị khử hơn H 2 O nên Cu 2+ được ưu tiên điện phân trước:
Cu 2+ + 2e → Cu
Đáp án A
12.9
Dựa vào các giá trị thế điện cực chuẩn sau, hãy giải thích vì sao khi điện phân dung dịch NaCl có màng ngăn lại không thu được Na kim loại. Viết phương trình phản ứng điện phân đầu tiên xảy ra ở cathode.
|
Cặp oxi hoá – khử |
2H 2 O/H 2 +2OH - |
Na + /Na |
|
Thế điện cực chuẩn (V) |
-0,83 |
-2,71 |
Phương pháp giải:
Dựa vào quá trình điện phân dung dịch.
Lời giải chi tiết:
Do thế điện cực chuẩn lớn hơn nên H 2 O có tính oxi hóa mạnh hơn Na + , do vậy sẽ bị điện phân trước ở cathode (cực âm) theo phương trình:
2H 2 O + 2e → H 2 + 2OH -
12.10
Trong một dung dịch có đồng thời các ion kim loại: Fe 2+ , Cu 2+ , Ag + , Zn 2+ . Hãy lập luận để chỉ ra thứ tự điện phân của các ion ở cathode.
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Dựa theo bảng thế điện cực chuẩn
|
Cặp oxi hóa khử |
Fe 2+/ Fe |
Cu 2+ /Cu |
Ag + /Ag |
Zn 2+/ Zn |
|
Thế điện cực chuẩn V |
-0,440 |
0,340 |
0,799 |
-0,763 |
Vì thế điện cực chuẩn càng lớn thì dạng oxi hóa có tính oxi hóa càng mạnh, do đó được điện phân trước. Vậy thứ tự điện phân ở cathode lần lượt là Ag + , Cu 2+ , Fe 2+ , Zn 2+
12.11
Cần mạ một lớp Ag lên một mặt của một chiếc đĩa tròn có bán kính 12 cm. Với độ dày lớp mạ là 0,01 mm, nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2 A trong thời gian t = 3 giờ thì có đủ để mạ theo yêu cầu trên không? Biết rằng khối lượng riêng của Ag là 10,5 g cm -3 , hiệu suất điện phân là 100%.
Phương pháp giải:
Dựa vào công thức faraday.
Lời giải chi tiết:
Diện tích của mặt đĩa là S = \(\pi {r^2} = \pi {12^2} = 452,16c{m^2}\)
Thể tích của lớp mạ Ag cần là
V=S.d=452,16.0,001 = 0,45216 cm 3
Khối lượng Ag cần để mạ là
M = V.d= 0,45216.10,5=4,75 gam
Số mol Ag cần để mạ là
4,75: 108= 0,044mol
Từ PT phản ứng điện phân
\(A{g^ + } + 1e \to Ag\) suy ra số mol electron cần cho điện phân lượng Ag trên là 0,044 mol
Theo công thức \({n_e} = \frac{{It}}{F} = \frac{{2.3.60.60}}{{96500}} = 0,2238mol > 0,044mol\)
Vậy lượng điện cung cấp trong thời gian trên đủ để mạ điện chiếc đĩa nói trên