Bài 6. Nồng độ của dung dịch trang 16, 17, 18 SBT Khoa học tự nhiên 8 Cánh diều
ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3, độ tan của KNO3 ở 25oC là
6.1
ở 25 o C, 250 gam nước có thể hòa tan tối đa 80 gam KNO 3 , độ tan của KNO 3 ở 25 o C là
A. 32 gam/ 100 gam H 2 O
B. 36 gam/ 100 gam H 2 O
C. 80 gam/ 100 gam H 2 O
D. 40 gam/ 100 gam H 2 O
Phương pháp giải:
Độ tan của một chất là số gam chất đó tan được trong 100 gam dung môi
Lời giải chi tiết:
Độ tan của chất ở 25 0 C = \(\frac{{100.80}}{{250}} = 32gam\)
Đáp án: A
6.2
Khối lượng của CuSO 4 có trong 100ml dung dịch CuSO 4 0,5 M là
A. 80 gam
B. 160 gam
C. 16 gam.
D. 8 gam.
Phương pháp giải:
Nồng độ dung dịch =\(\frac{n}{V}\)
Lời giải chi tiết:
n CuSO4 = 0,5 x 0,1 = 0,05 🡪 m CuSO4 = 0,05 x 160 = 8 gam
Đáp án: D
6.3
Rót 300ml nước vào bình có chứa sẵn 200ml sodium chloride 0,5M và lắc đều, thu được dung dịch sodium chloride mới. Nồng độ mol của dung dịch thu được là
A. 0,05 M
B. 0,10 M C. 0,20 M
D. 0,30 M.
Phương pháp giải:
Nồng độ dung dịch =\(\frac{n}{V}\)
Lời giải chi tiết:
n NaCl = 0,5 x 0,2 = 0,1 mol
Nồng độ mol của dung dịch thu được là: \(\frac{{0,1}}{{0,2 + 0,3}} = 0,2M\)
Đáp án: C
6.4
Đồ thị sau cho biết ảnh hưởng của nhiệt độ đến độ tan của ba chất khác nhau trong nước.
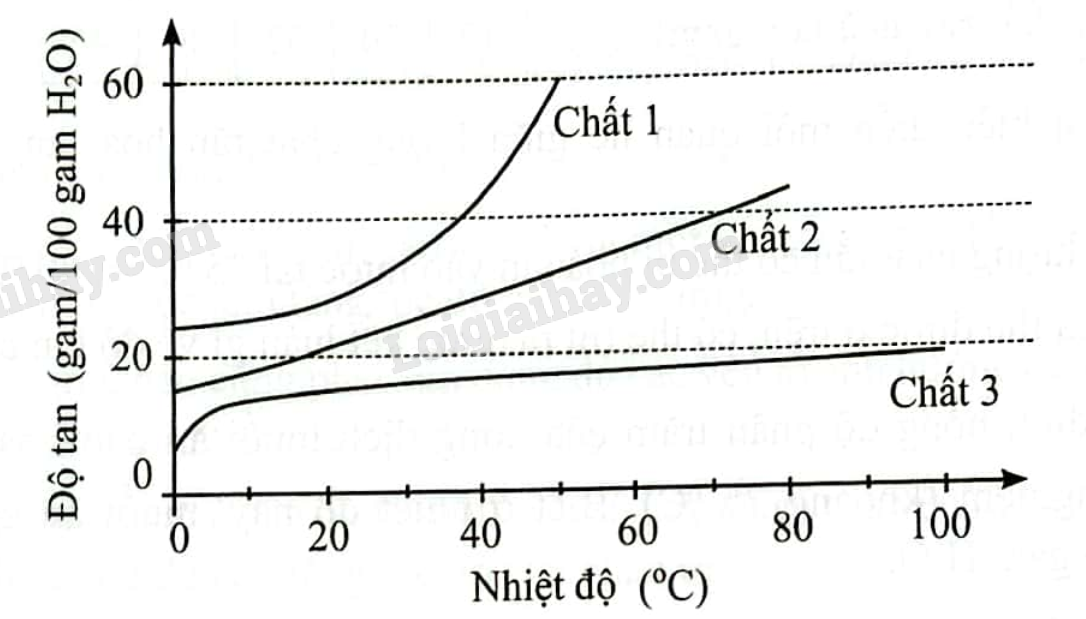
Nhận xét nào sau đây là đúng?
A. Đối với chất 1, khi nhiệt độ tăng thì độ tan giảm.
B. Độ tan của chất 2 ở 70 o C gấp đôi ở 0 o C.
C. Ở 20oC, độ tan của chất 1 gấp đôi chất 3.
D. Độ tan của chất 3 ở 60 o C lớn hơn độ tan của chất 1 ở 20 o C.
Phương pháp giải:
Dựa vào đồ thị về sự ảnh hưởng của nhiệt độ đến độ tan của các chất khác nhau trong nước
Lời giải chi tiết:
Đáp án: C
6.5
Sử dụng từ ngữ thích hợp cho sẵn để điền vào chỗ … Mỗi từ ngữ có thể sử dụng một lần hoặc nhiều lần hoặc không lần nào
Hòa tan Bão hòa nước hỗn hợp nhiệt độ chất không tan
dung môi thể rắn chất tan bay hơi thể tích dung dịch
Dung dịch là ..(a).. lỏng đồng nhất của các chất đã tan trong nhau. Chất tan là chất ..(b).. trong chất lỏng. Chất lỏng hòa tan chất tan được ..(c).. Chất tan và dung môi tạo thành.. (d).. Chất rắn không tan trong chất lỏng được gọi là .. (e)…
Độ tan của một chất rắn trong nước được đo bằng lượng chất rắn có trong 100.. (g).. độ tan của một chất phụ thuộc vào … (h)…
Phương pháp giải:
Dựa vào khái niệm nồng độ mol, nồng độ phần trăm, độ tan của chất
Lời giải chi tiết:
(a) hỗn hợp
(b) hòa tan
(c) dung môi
(d) dung dịch
(e) chất không tan
(g) nước
(h) nhiệt độ
6.6
Đọc thông tin và lựa chọn số liệu thích hợp điền vào chỗ … trong các câu sau:
Cách pha chế 50ml dung dịch NaOH nồng độ 1M: cân ..(1).. gam NaOH, cho vào cốc thủy tinh dung dịch 100ml. Đổ dần nước cất vào cốc và khuấy nhẹ đến vạch..(2).. ml thì dừng lại, thu được …(3)… ml dung dịch NaOh nồng độ ..(4)…M.
Phương pháp giải:
Dựa vào khái niệm nồng độ của dung dịch.
Lời giải chi tiết:
(1) 2,0
(2) 50
(3) 50
(4) 1
6.7
Để kiểm tra độ tan của một chất rắn chưa biết, một nhóm học sinh cho chất rắn đó vào 200ml nước. Kết quả cho thấy độ tan của chất rắn thay đổi ở nhiệt độ khác nhau của nước. Cụ thể như sau:
|
Nhiệt độ của nước ( o C) |
25 |
30 |
45 |
55 |
65 |
70 |
75 |
|
Khối lượng chất rắn hòa tan (gam) |
17 |
20 |
32 |
40 |
46 |
49 |
52 |
Vẽ đồ thị biểu diễn mối quan hệ giữa lượng chất rắn hòa tan và nhiệt độ của nước.
Dự đoán lượng chất rắn có thể bị hòa tan vào nước tại 35 o C và 80 o C.
Từ kết quả thu được ở trên, có thể rút ra được kết luận gì về độ tan của chất?
Phương pháp giải:
Nồng độ dung dịch của chất.
Lời giải chi tiết:
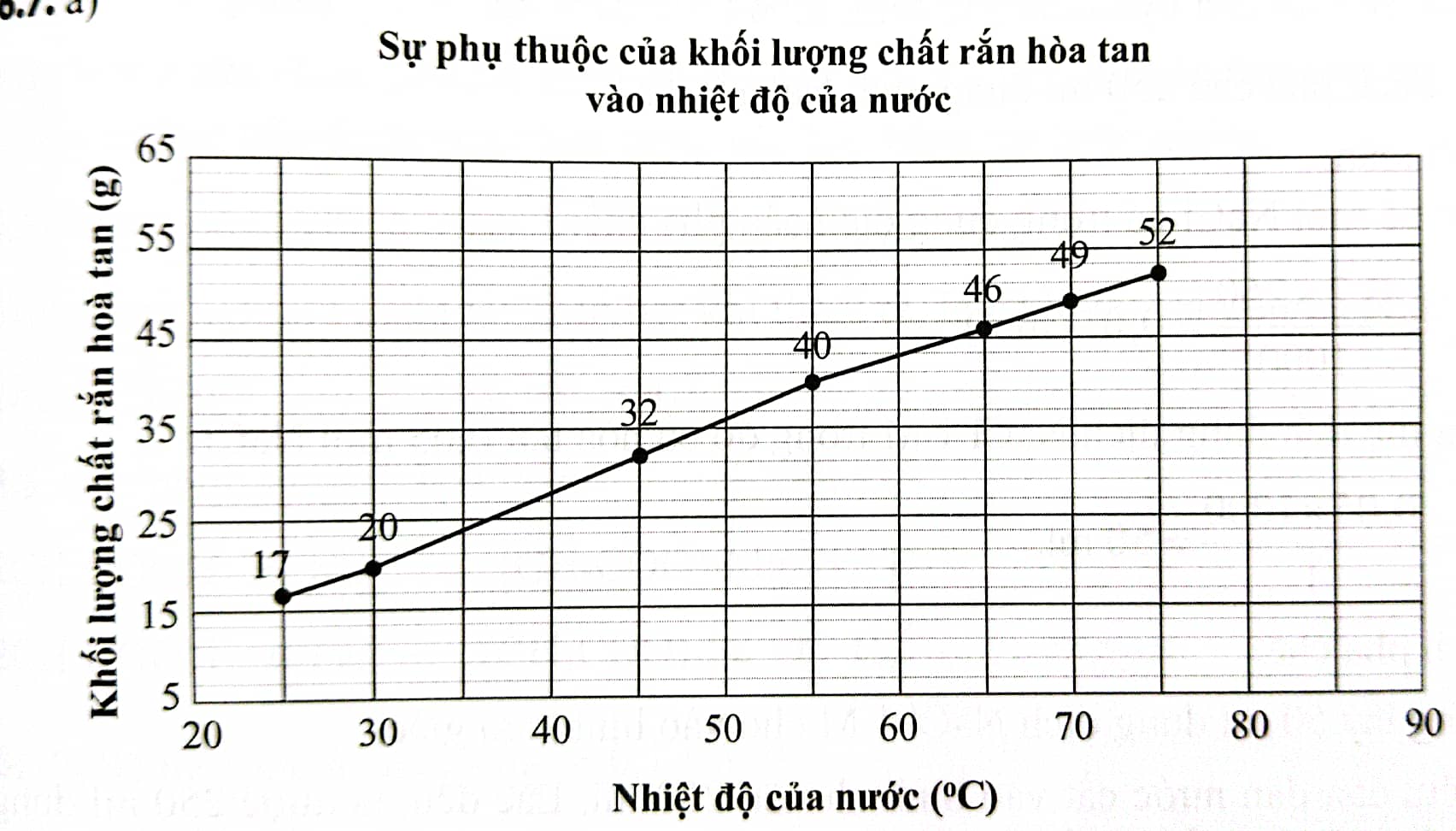
b) Lượng chất rắn có thể bị hòa tan vào 200ml nước 35 0 C là khoảng 24gam và ở 80 o C là khoảng 56 gam.
c) Từ kết quả thu được ở trên, có thể thấy độ tan của chất tăng khi nhiệt độ tặng.
6.8
Xác định nồng độ phần trăm của dung dịch muối ăn bão hòa ở nhiệt độ phòng thí nghiệm (khoảng 25 o C). Biết ở nhiệt độ này, muối ăn có độ tan là 36 gam/ 100 gam H 2 O.
Phương pháp giải:
Dựa vào công thức tính độ tan của chất trong nước
Lời giải chi tiết:
Độ tan của NaCl ở 25 0 C là 36 gam/100 gam nước tức là cứ 100 gam nước có thể hòa tan 36 gam NaCl.
m NaCl = 36 gam; m dd = m NaCl + m nước = 36 + 100 = 136 (gam)
C%\( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% = \frac{{36}}{{136}}.100 = 26,47\% \)
6.9
Tính nồng độ mol của dung dịch sulfuric acid biết 250 ml dung dịch chứa 9,8 gam H 2 SO 4
Phương pháp giải:
Nồng độ dung dịch =\(\frac{n}{V}\)
Lời giải chi tiết:
n H2SO4 =\(\frac{{9,8}}{{98}} = 0,1mol\)
Nồng độ mol của dung dịch sulfuric acid: \({C_M} = \frac{{0,1}}{{0,25}} = 0,4M\)
6.10
Cần cho thêm bao nhiêu gam NaOH vào 120 gam dung dịch NaOH 20% để thu được dung dịch có nồng độ 25%?
Phương pháp giải:
Nồng độ dung dịch \( = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \)
Lời giải chi tiết:
Khối lượng NaOH và nước có trong dung dịch ban đầu là
m NaOH = 120 x 20% = 24 gam 🡪 m H2O = 120 – 24 = 96 gam
Trong dung dịch mới, nước chiếm: 100 – 25 = 75%
Khối lượng của dung dịch NaOH 25% là:\(\frac{{96.100}}{{75}} = 128g\)
Vậy khối lượng NaOH cần thêm là: 128 -120 = 8 gam.
6.11
25ml sodium hydroxide 0,20 M phản ứng vừa đủ với 10ml hydrochloric acid theo phương trình hóa học: HCl + NaOH 🡪 NaCl + H 2 O
Phương pháp giải:
Nồng độ dung dịch = \(\frac{n}{V}\)
Lời giải chi tiết:
Xác định nồng độ mol của dung dịch acid.
n NaOH =\(\frac{{0,2.25}}{{1000}} = {5.10^{ - 3}}\)
n HCl = n NaOH = 5.10 -3
Nồng độ mol của dung dịch là: \(\frac{{{{5.10}^{ - 3}}}}{{10}}.1000 = 0,5M\)
6.12
Quan sát dụng cụ chứa dung dịch hydrochloric acid 0,01 M (hình 6.1).

a) Cho biết tên của dụng cụ thí nghiệm.
b) Xác định thể tích của dung dịch hydrochloric acid.
c) Tính số mol của hydrochloric acid trong dụng cụ trên.
Phương pháp giải:
Nồng độ dung dịch của chất.
Lời giải chi tiết:
a) Dụng cụ thí nghiệm là ống đong
b) Thể tích của dung dịch hydrochloric acid là 44 ml (cm 3 )
c) Số mol của hydrochloric acid trong dụng cụ trên là: 0,04 x 0,01 = 4,4 x 10 -4
6.13
Từ dung dịch NaCl 1M, hãy trình bày cách pha chế 250ml dung dịch NaCl 0,2M.
Phương pháp giải:
Nồng độ dung dịch = \(\frac{n}{V}\)
Lời giải chi tiết:
Tìm số mol của NaCl cần pha chế:
n NaCl = \(\frac{{0,2.250}}{{1000}} = 0,05mol\)
Tìm thể tích dung dịch NaCl 1M trong đó có hòa tan 0,05 mol
V dd = \(\frac{{0,05.1000}}{1} = 50ml\)
Cách pha chế:
Đong lấy 50 ml dung dịch NaCl 1M cho vào bình tam giác
Thêm dần dần nước cất vào bình cho đủ 250 ml. Lắc đều, ta được 250 ml dung dịch NaCl 0,2M cần pha chế.