Bài 18. Tính chất chung của kim loại trang 56, 57, 58 SBT Khoa học tự nhiên 9 Kết nối tri thức
Dùng búa đập vào sợi dây nhôm, sợi dây bị cán mỏng dẹt ra. Điều này chứng tỏ nhôm có
18.1
Dùng búa đập vào sợi dây nhôm, sợi dây bị cán mỏng dẹt ra. Điều này chứng tỏ nhôm có
A. tính dẻo B. tính cứng C. tính rắn chắc D. tính bền.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Dùng búa đập vào sợi dây nhôm, sợi dây bị cán mỏng dẹt ra điều này chứng tỏ nhôm có tính dẻo.
Đáp án A
18.2
Dùng đồng để làm một cột thu lôi chống sét vì đồng có tính
A. bền B. ánh kim C. dẫn điện D. dẻo
Phương pháp giải:
Dựa vào tính chất dẫn điện của đồng.
Lời giải chi tiết:
Dùng đồng để làm một cột thu lôi chống sét vì đồng có tính dẫn điện.
Đáp án C
18.3
Một bạn quan sát thấy bề mặt một vật sáng lấp lánh dưới ánh nắng. Đó có thể là bề mặt vật nào sau đây?
A. Viên bi nhựa B. Mảnh giấy nhôm
C. Thanh đất sét D. Tờ giấy
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Đó là mảnh giấy nhôm vì nhôm có tính ánh kim.
Đáp án B
18.4
Kim loại nào sau đây phản ứng với nước ở điều kiện thường, giải phóng khí hydrogen?
A. Cu B. Au C. Fe D. K
Phương pháp giải:
Các kim loại mạnh như Na, K, Ca, Ba có phản ứng với nước ở điều kiện thường, giải phóng khí hydrogen.
Lời giải chi tiết:
K là kim loại mạnh phản ứng với nước ở điều kiện thường.
Đáp án D
18.5
Kim loại nào sau đây không tác dụng với dung dịch HCl?
A. Na B. Mg C. Ag D. Al
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Au không tác dụng với dung dịch HCl.
Đáp án B
18.6
Kim loại nào sau đây tác dụng với hơi nước ở nhiệt độ cao tạo thành oxide kim loại?
A. Zn. B. Cu C. Ag D. Au
Phương pháp giải:
Dựa vào phản ứng giữa kim loại và oxygen.
Lời giải chi tiết:
Zn phản ứng với hơi nước ở nhiệt độ cao tạo thành oxide kim loại.
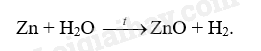
Đáp án A
18.7
Cho một mẩu calcium vào dung dịch HCl, hiện tượng quan sát được là
A. calcium không phản ứng.
B. calcium không tan nhưng có bọt khí thoát ra.
C. calcium tan và có bọt khí thoát ra.
D. calcium tan, không có bọt khí thoát ra.
Phương pháp giải:
Dựa vào phản ứng giữa kim loại và dung dịch acid.
Lời giải chi tiết:
Khi cho mẩu calcium vào dung dịch HCl, calcium tan và có bọt khí thoát ra.
Ca + 2HCl \( \to \)CaCl 2 + H 2
Đáp án C
18.8
Cho các kim loại nhôm, sắt, vàng tác dụng với oxygen. Cho biết các hiện tượng xảy ra sau đây tương ứng với kim loại nào.
a) Cháy sáng chói trong không khí tạo thành chất rắn màu trắng.
b) Không phản ứng với oxygen.
c) Cháy trong không khí tạo khói màu nâu đỏ.
Phương pháp giải:
Dựa vào phản ứng giữa kim loại và oxygen.
Lời giải chi tiết:
a) Al
b) Au
c) Fe.
18.9
Đốt nóng các kim loại natri, sắt, đồng và lần lượt cho vào bình đựng khí chlorine. Sản phẩm sau phản ứng được hòa tan vào nước thu được dung dịch có các màu:
a) vàng nâu b, xanh lam c) không màu.
Cho biết mỗi dung dịch trên tương ứng với kim loại nào, viết phương trình hóa học (PTHH) của phản ứng xảy ra.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
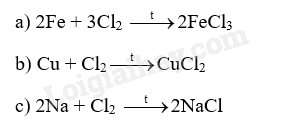
18.10
Cho sơ đồ thí nghiệm như mô tả trong Hình 18.1. Kẹp một số đồ vật bằng đồng, nhựa, gỗ, cao su, thủy tinh, thép, gốm bằng hai kẹp vật liệu. Đóng công tắc điện và quan sát bóng đèn.
a) Dự đoán hiện tượng xảy ra với đồ vật bằng đồng, nhựa, gỗ, cao su, thủy tinh, thép, gốm trong thí nghiệm trên.
b) Thí nghiệm này chứng minh tính chất gì của kim loại?
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
a) Các đồ vật bằng nhựa, gỗ, cao su, thủy tinh, gốm không làm cho bóng đèn sáng. Đồ vật bằng thép, đồng có khả năng dẫn điện nên bóng đèn sáng.
b) Thí nghiệm trên chứng minh tính dẫn điện của kim loại.
18.11
Cho sơ đồ thí nghiệm như mô tả trong Hình 18.2
Đổ nước nóng (khoảng 90 o C) vào bát. Đặt các thìa làm bằng kim loại, nhựa, gỗ, sứ vào bát nước. Sau khoảng 2 – 3 phút cầm vào cán mỗi chiếc thìa và nhận xét sự thay đổi nhiệt độ các loại thìa. Lặp lại thí nghiệm với bát đựng nước lạnh có vài viên đá.
a) Dự đoán hiện tượng xảy ra trong thí nghiệm trên.
b) Thí nghiệm này chứng minh tính chất gì của kim loại?
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
a) Khi cầm vào cán thìa làm bằng nhựa, gỗ, sứ không có hiện tượng nóng ở cán thìa.
Khi cầm vào cán thìa làm bằng kim loại có hiện tượng nóng ở cán thìa.
Tương tự với bát đựng nước lạnh có vài viên đá.
b) Thí nghiệm này chứng minh tính dẫn nhiệt của kim loại.
18.12
Khi để lâu trong không khí, thép (thành phần chính là sắt) bị han gỉ trong khi vàng vẫn sáng bóng. Trong các phát biểu sau đây, câu nào đúng, câu nào sai?
a) Sắt phản ứng với oxygen trong không khí, còn vàng không phản ứng.
b) Sắt hoạt động hóa học mạnh hơn vàng.
c) Vàng trơ về mặt hóa học
d) Vàng có ánh kim, còn thép không có ánh kim.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
a) đúng
b) đúng
c) đúng
d) sai, thép cũng có ánh kim.
18.13
Trong thí nghiệm: Khi cho một mẩu natri vào chậu nước, quan sát thấy mẩu natri nóng chảy, sau đó bốc cháy.
a) Viết PTHH của phản ứng giữa natri và nước.
b) Giải thích tại sao mẩu natri nóng chảy.
c) Giải thích tại sao có lửa cháy từ vị trí mẩu natri. Viết PTHH của phản ứng.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại
Lời giải chi tiết:
a) Na + H 2 O → NaOH + ½ H 2
b) Vì Na là kim loại mạnh, phản ứng mãnh liệt với nước.
c) Khí H2 sinh ra, phản ứng với O 2 trong nước.
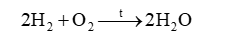
18.14
Cho một lá đồng có khối lượng 4g vào 100 ml dung dịch silver nitrate 0,5M. Sau khoảng 15 phút lấy lá kim loại ra, rửa nhẹ, làm khô, cân được 7,04g (giả sử toàn bộ bạc sinh ra đều bám trên lá đồng). Tính nồng độ các chất trong dung dịch sau phản ứng.
Phương pháp giải:
Dựa vào phản ứng giữa đồng và dung dịch silver nitrate: Cu + 2AgNO 3 →Cu(NO 3 ) 2 + 2Ag
Lời giải chi tiết:
n AgNO3 = 0,1.0,5 = 0,05 mol. Đặt số mol Cu phản ứng là x (mol). Theo phương trình ta có:
Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag
x 2x x 2x
Khối lượng kim loại tăng = m Ag – m Cu
→ 7,04 – 4 = 108.2x – 64x \( \to \)x = 0,02 mol.
n AgNO3 dư = 0,05 – 0,02 = 0,03 mol; n Cu(NO3)2 = 0,02 mol
CM AgNO3 = \(\frac{{0,03}}{{0,1}} = 0,3M\)
CM Cu(NO3)2 = \(\frac{{0,02}}{{0,1}} = 0,2\)
18.15
Một hỗn hợp gồm sắt và đồng. Hãy trình bày cách tách riêng từng kim loại trong hỗn hợp này bằng phương pháp hóa học.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Có thể dùng acid HCl để tách hỗn hợp vì Fe phản ứng với HCl, Cu không phản ứng.
18.16
Cho hỗn hợp nhôm và sắt tác dụng với dung dịch Cu(NO 3 ) 2 thu được dung dịch A và chất rắn B gồm hai kim loại. Khi cho chất rắn B tác dụng với dung dịch HCl thấy có bọt khí thoát ra.
a) Chất rắn B không chứa kim loại nào sau đây?
A. Fe và Al B. Cu C. Al D. Fe.
b) Giải thích sự lựa chọn trên.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
a) Chất rắn B không chứa Al
b) Vì Al phản ứng hết với Cu(NO 3 ) 2 , sau đó Cu(NO 3 ) 2 còn dư sẽ tác dụng với Fe. Nên chất rắn B gồm Cu và Fe.
18.17
Một mẫu đồng bị lẫn tạp chất là nhôm và sắt. Để xác định hàm lượng tạp chất có trong mẫu trên, người ta lấy 5g mẫu hòa tan trong 100ml dung dịch HCl 2M. Sau phản ứng hoàn toàn, cân lại thấy lượng chất rắn không tan là 4,45g, nồng độ dung dịch HCl còn lại là 1,6M. Tính hàm lượng phần trăm của nhôm và sắt có trong mẫu.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Khi cho mẫu đồng phản ứng với dung dịch HCl thấy có chất rắn không tan \( \to \)chất rắn là Cu.
m chất rắn phản ứng = 5 – 4,45 = 0,55g
Gọi số mol của Fe và Al lần lượt là x và y mol.
Fe + 2HCl \( \to \)FeCl 2 + ½ H 2
x \( \to \)2x
2Al + 6HCl \( \to \)2AlCl 3 + 3H 2
y \( \to \)3y
n HCl phản ứng = 0,1.0,4 = 0,04 mol
Ta có hệ phương trình sau:
\(\begin{array}{l}\left\{ \begin{array}{l}{m_{Fe}} + {m_{Al}} = 56{\rm{x}} + 27y = 0,55\\{n_{HCl}} = 2{\rm{x}} + 3y = 0,04\end{array} \right.\\ \to \left\{ \begin{array}{l}x = 0,005\\y = 0,01\end{array} \right.\end{array}\)
%m Al = \(\frac{{0,01.27}}{{0,55}}.100\% = 49,1\% \)
%m Fe = \(\frac{{0,005.56}}{{0,55}}.100\% = 50,9\% \)
18.18
Để xác định tên một kim loại, một bạn hòa tan hoàn toàn 0,9g kim loại đó trong dung dịch HCl 2,5M và thấy dùng hết 40ml dung dịch. Hãy xác định kim loại trên (biết hóa trị của kim loại trong khoảng từ I đến III).
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Gọi kim loại là R và hóa trị kim loại là x.
n HCl = 0,04.2,5 = 0,1 mol
2R + 2xHCl \( \to \)2RCl x + 2H 2
\(\frac{{0,1}}{x}\) \( \leftarrow \) 0,1
M R = \(\frac{{0,9}}{{\frac{{0,1}}{x}}} = 9{\rm{x}}\).
Vì hóa trị của kim loại từ I đến III nên x có giá trị từ 1 đến 3.
Khi x = 3 thì MR = 27 (Al).
18.19
Một bạn dùng dao cắt một mẩu natri, thấy bề mặt kim loại có vẻ sáng lấp lánh. Sau đó, bề mặt này nhanh chóng bị xỉn màu và mất vẻ sáng lấp lánh.
a) Tại sao bề mặt natri bị mất vẻ sáng nhanh chóng?
b) Để bảo quan kim loại natri, cần ngâm chìm miếng natri trong dầu hỏa mà không để trong không khí. Hãy giải thích.
c) Khi lấy natri, chỉ được dùng panh để kẹp mà không được dùng tay cầm trực tiếp. Hãy giải thích.
Phương pháp giải:
Dựa vào tính chất vật lí và tính chất hóa học của kim loại.
Lời giải chi tiết:
a) Vì natri là kim loại mạnh có thể phản ứng với oxygen hoặc hơi nước trong không khí nên nhanh chóng bị mất vẻ sáng.
b) Vì Na dễ dàng phản ứng với nước nên cần bảo quản bằng cách ngâm trong dầu hỏa.
c) Vì Na có thể phản ứng với nước trong các tế bào da tay, gây bỏng tay nên chỉ được dùng panh để kẹp.
18.20
Một dung dịch A có chứa CuSO 4 và FeSO 4 . Nhúng sợi dây nhôm vào dung dịch A và thấy các trường hợp sau:
a) Sau phản ứng thấy dung dịch có 3 muối tan.
b) Sau phản ứng thấy dung dịch có 2 muối tan.
c) Sau phản ứng thấy dung dịch có 1 muối tan.
Hãy giải thích mỗi trường hợp bằng PTHH của phản ứng.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
a) 2Al + 3CuSO 4 \( \to \)Al 2 (SO 4 ) 3 + 3Cu
3 dung dịch muối tan gồm: Al 2 (SO 4 ) 3 , CuSO 4 dư, FeSO 4 .
b) 2Al + 3CuSO 4 \( \to \)Al 2 (SO 4 ) 3 + 3Cu
2Al + 3FeSO 4 \( \to \)Al 2 (SO 4 ) 3 + 3Fe
2 dung dịch muối tan gồm: Al 2 (SO 4 ) 3 và FeSO 4 dư.
c) 2Al + 3CuSO 4 \( \to \)Al 2 (SO 4 ) 3 + 3Cu
2Al + 3FeSO 4 \( \to \)Al 2 (SO 4 ) 3 + 3Fe
1 dung dịch muối tan gồm: Al 2 (SO 4 ) 3 .