Bài 20. Tách kim loại và việc sử dụng hợp kim trang 63, 64 SBT Khoa học tự nhiên 9 Kết nối tri thức
Kim loại Na được điều chế bằng phương pháp nào sau đây?
20.1
Kim loại Na được điều chế bằng phương pháp nào sau đây?
A. Phương pháp điện phân nóng chảy
B. Phương pháp nhiệt luyện với chất phản ứng là CO.
C. Phương pháp nhiệt luyện với chất phản ứng là H 2
D. Phương pháp thủy luyện
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Vì kim loại Na là kim loại hoạt động hóa học mạnh nên được điều chế bằng phương pháp điện phân nóng chảy.
Đáp án A
20.2
Phương pháp nhiệt luyện với chất phản ứng CO có thể tách được kim loại nào sau đây ra khỏi oxide của nó?
A. Fe B. K. C. Ca D. Al.
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Phương pháp thủy luyện để tách các kim loại trung bình và yếu như Fe, Cu, Ag.
Đáp án A
20.3
Thành phần chính của quặng bauxite là
A. Fe 3 O 4 B. Al 2 O 3 C. AlCl 3 D. Al 2 (SO 4 ) 3
Phương pháp giải:
Dựa vào thành phần của một số quặng điều chế kim loại.
Lời giải chi tiết:
Quặng bauxite thành phần chính chứa Al 2 O 3 dùng để sản xuất nhôm
Đáp án B
20.4
Chất/ các chất phản ứng dùng để tách kẽm ra khỏi kẽm sulfile là
A. CO. B. O 2 và C C. HCl và Al D. H 2 .
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Kẽm sulfile có thành phần chính là ZnS. Để tách kẽm ra khỏi ZnS người ta sử dụng O 2 và C theo sơ đồ sau:
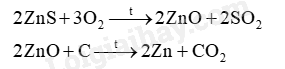
Đáp án B
20.5
Kim loại cơ bản của hợp kim duy – ra (duralumin) là
A. Fe B. Cu C. Al D. Mg
Phương pháp giải:
Dựa vào một số hợp kim thông dụng.
Lời giải chi tiết:
Kim loại cơ bản của hợp kim duy – ra là Al.
Đáp án C
20.6
Gang và thép có thành phần nguyên tố cơ bản nào khác nhau?
A. Sắt B. Manganese C. Carbon D. Nickel.
Phương pháp giải:
Dựa vào một số hợp kim thông dụng.
Lời giải chi tiết:
Gang và thép đều có thành phần nguyên tố cơ bản là sắt.
Đáp án A
20.7
Chất nào sau đây không phải là nguyên liệu sản xuất gang?
A. Quặng sắt B. Than cốc C. Đá vôi D. Đất sét
Phương pháp giải:
Dựa vào quy trình sản xuất gang, thép.
Lời giải chi tiết:
Đất sét không phải là nguyên liệu sản xuất gang.
Đáp án D
20.8
Chất nào sau đây không phải là nguyên liệu sản xuất thép?
A. Gang B. Thép phế liệu
C. Khí oxygen D. Khí carbon dioxide.
Phương pháp giải:
Dựa vào quy trình sản xuất gang, thép.
Lời giải chi tiết:
Khí CO2 không phải nguyên liệu sản xuất thép.
Đáp án D
20.9
Điện phân nóng chảy 1,53 tấn Al 2 O 3 giả thiết hiệu suất 100%, thu được khối lượng nhôm là
A. 810 kg B. 720kg C. 405kg D. 360kg
Phương pháp giải:
Dựa vào phản ứng điện phân nóng chảy Al 2 O 3 :
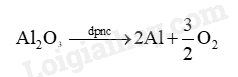
Lời giải chi tiết:

102n 54n
1,53 tấn ?
m Al = \(\frac{{1,53.54n}}{{102n}} = 0,81\tan \)=810kg
Đáp án A
20.10
Một đồ vật bằng vàng tây, thành phần gồm có vàng và bạc, nặng 0,453g; trong đó, khối lượng vàng là 0,170g. Thành phần phần trăm khối lượng của vàng trong loại vàng tây đó là
A. 62,5% B. 37,5% C. 17,0% D. 45,3%
Phương pháp giải:
Dựa vào công thức tính % khối lượng các nguyên tố trong hợp chất.
Lời giải chi tiết:
% khối lượng vàng là: \(\frac{{0,170}}{{0,453}}.100\% = 37,5\% \)
Đáp án B
20.11
Cần ít nhất bao nhiêu tấn Fe 2 O 3 để thu được 1 tấn gang có hàm lượng sắt 96,6%?
A. 1,035 tấn B. 1,480 tấn C. 0,69 tấn D. 1,38 tấn
Phương pháp giải:
Dựa vào phản ứng tạo gang.
Lời giải chi tiết:
Khối lượng sắt có trong 1 tấn gang là: 1.96,6% = 0,966 tấn.
Khối lượng Fe 2 O 3 cần để sản xuất 0,966 tấn sắt là:
\(\begin{array}{l}F{e_2}{O_3} \to {\rm{ }}Fe\\160n \to {\rm{ 112n}}\\\frac{{0,966.160n}}{{112n}}{\rm{ 0,966tan}}\end{array}\)
m = 1,38 tấn.
Đáp án D
20.12
Từ 1 tấn gang có hàm lượng sắt 96% có thể thu được tối đa bao nhiêu kg thép có hàm lượng sắt 99%?
A. 960,0kg B. 950,4kg C. 969,7kg D. 1010kg.
Phương pháp giải:
Dựa vào phương pháp sản xuất gang, thép
Lời giải chi tiết:
Khối lượng sắt có trong 1 tấn gang là: 1.96% = 0,96 tấn = 960kg
Khối lượng thép có hàm lượng sắt 99% là: 960:99% = 969,7kg
Đáp án C
20.13
Trong quá tình điện phân nóng chảy aluminium oxide, cryolite được trộn vào để làm gì?
Phương pháp giải:
Dựa vào phương pháp điện phân nóng chảy aluminium oxide.
Lời giải chi tiết:
Cryolite đóng vai trò làm giảm nhiệt độ nóng chảy, tăng tính dẫn điện và chống oxi hóa nhôm lỏng tạo thành.
20.14
Điện cực than chì có bền không trong quá trình điện phân nóng chảy alumnium oxide?
Phương pháp giải:
Dựa vào phương pháp điện phân nóng chảy aluminium oxide.
Lời giải chi tiết:
Điện cực than chỉ không bền. Oxygen sinh ra sẽ đốt cháy dần điện cực than chì, tạo khí CO 2 và CO.
20.15
Tại sao hợp kim được sử dụng phổ biến trong công nghiệp và cuộc sống?
Phương pháp giải:
Dựa vào đặc tính của hợp kim.
Lời giải chi tiết:
Hợp kim có nhiều ưu điểm so với kim loại thành phần, đặc biệt về tính chất vật lí. Ví dụ hợp kim của nhôm được ứng dụng rộng rãi trong chế tạo thân vỏ máy bay, ô tô,…
20.16
Khí lò cao trong sản xuất gang thép thường chứa các khí gì? Các khí này ảnh hưởng thế nào tới môi trường xung quanh? Em hãy đề xuất cách xử lí các khí này trước khi thải ra môi trường xung quanh.
Phương pháp giải:
Dựa vào quá trình sản xuất gang, thép.
Lời giải chi tiết:
Khí thoát ra từ lò cao sản xuất gang thường có nhiều CO 2 , CO và một số khí như SO 2 , NO, NO 2 , CH4,…. Gây ra sự gia tăng hiệu ứng nhà kính, mưa acid và ô nhiễm không khí,…Cần đốt cháy và hấp thụ sản phẩm vào một số dung dịch như Ca(OH) 2 .
20.17
Từ 1 tấn quặng sphalerite chứa 97% ZnS thu được khối lượng Zn và khối lượng SO 2 phát thải là bao nhiêu, biết hiệu suất của mỗi phản ứng là 90%? Khối lượng than cốc cần dùng cho quặng sphalerite là bao nhiêu, biết lượng cần dùng dư 20% so với lượng phản ứng?
Phương pháp giải:
Dựa vào phương pháp tách kẽm ra khỏi quặng sphalerite.
Lời giải chi tiết:
Khối lượng ZnS có trong quặng là: 1.97% = 0,97 tấn = 970kg.
n ZnS = \(\frac{{{{970.10}^3}}}{{97}} = 10000mol\)
Phản ứng: 2ZnS + 3O 2 \( \to \)2ZnO + 2SO 2
Vì hiệu suất phản ứng là 90% nên:
n ZnO = 10000.90% = 9000 mol; n SO2 = 10000.90% = 9000 mol
ZnO + C\( \to \)Zn + CO
Vì hiệu suất phản ứng là 80% nên:
n Zn = 9000.80% = 8100 mol
khối lượng SO 2 = 64 . 9000 = 576000g = 576kg
Khối lượng Zn: 65.8100 = 526500g = 526,5kg
Khối lượng thân cốc cần dùng là: 12.81000 : 80% = 116 640g = 116,61kg
20.18
Nhúng một thanh kẽm vào 200ml dung dịch AgNO 3 . Sau khi phản ứng xảy ra hoàn toàn, Ag sinh ra bám hết vào thanh kẽm, khối lượng thanh kim loại thu được tăng 1,51g. Xác định nồng độ dung dịch AgNO 3 ban đầu.
Phương pháp giải:
Dựa vào phương pháp thủy luyện để tách kim loại.
Lời giải chi tiết:
Gọi số mol Zn phản ứng là x mol:
Zn + 2AgNO 3 \( \to \)Zn(NO 3 ) 2 + 2Ag
x 2x 2x
Khối lượng thanh kim loại tăng = m Ag – m Zn
1,51 = 2x.108 – x.65 \( \to \)x = 0,01 mol
CM AgNO3 = \(\frac{{0,01.2}}{{0,2}} = 0,1M\)
20.19
Cho 8g một loại đồng thau (hợp kim đồng – kẽm) vào lượng dư dung dịch HCl 2M, sau khi phản ứng xảy ra hoàn toàn thu được 1,2395L khí hydrogen (đkc). Xác định thành phần của đồng thau (giả thiết hợp kim này chỉ chứa hai nguyên tố)
Phương pháp giải:
Dựa vào quá trình sản xuất hợp kim.
Lời giải chi tiết:
Hợp kim đồng – kẽm khi cho tác dụng với dung dịch HCl chỉ có kẽm phản ứng.
n H2 = 1,2395 : 24,79 = 0,05 mol
Zn + 2HCl \( \to \)ZnCl 2 + H 2
0,05 0,05
m Zn = 0,05.65 = 3,25g
%m Zn trong hợp kim là: \(\frac{{3,25}}{8}.100 = 40,625\% \)
%m Cu = 100% - 40,625% = 59,375%
20.20
Cho 4,958 L khí (đkc) CO đi qua ống sứ đựng 8g một oxide kim loại, nung nóng. Sau phản ứng thu được m gam kim loại M và hỗn hợp khí X có tỉ khôí so với hydrogen bằng 20. Tính giá trị m và xác định công thức oxide của kim loại M.
Phương pháp giải:
Dựa vào phản ứng nhiệt luyện để tách kim loại.
Lời giải chi tiết:
n CO = 4,958 : 24,79 = 0,2 mol
phản ứng: \({M_2}{O_n} + nCO \to 2M + nC{O_2}\)
số mol: a a.n 2a a.n
Vì hỗn hợp X có tỉ khoói so với khí H 2 bằng 20 nên MX = 40
bảo toàn khối lượng, ta có: m CO + m oxide = m kim loại + m X
\( \to \)28.0,2 + 8 = m kim loại + 40.0,2
\( \to \)m kim loại = 5,6g
Vậy (2M + 16n).a = 8 (1)
M.2a = 5,6 (2)
Từ (1), (2) \( \to \)na = 0,15\( \to \)M M2On = \(\frac{8}{{\frac{{0,15}}{n}}} = \frac{{56n}}{3}\)
Với n =3 \( \to \)M = 56 (Fe): oxide là Fe 2 O 3 .