Bài 19. Sự khác nhau cơ bản giữa phi kim và kim loại trang 49, 50 SBT Khoa học tự nhiên 9 Chân trời sáng tạo
Do có tính hấp phụ nên carbon vô định hình được dùng làm
19.1
Do có tính hấp phụ nên carbon vô định hình được dùng làm
A. điện cực, chất khử
B. mặt nạ phòng hơi độc
C. ruột bút chì, chất bôi trơn
D. mũi khoan, dao cắt kính
Phương pháp giải:
Sử dụng tính chất vật lí của phi kim và liên hệ thực tiễn và ứng dụng.
Lời giải chi tiết:
Đáp án B
19.2
Dãy phi kim nào sau đây tác dụng với oxygen tạo thành oxide acid
A. S, C, P
B. S, P, Cl 2
C. Si, P, Br 2
D. C, Cl 2 , Br 2
Phương pháp giải:
Sử dụng tính chất hóa học của phi kim.
Lời giải chi tiết:
Đáp án A
19.3
Dựa vào tính chất nào sau đây cho thấy sự khác nhau giữa kim loại và phi kim?
A. Màu sắc
B. Trạng thái
C. Kích thước
D. Nhiệt độ nóng chảy
Phương pháp giải:
Sử dụng kiến thức về tính chất vật lí của kim loại và phi kim.
Lời giải chi tiết:
Đáp án D
19.4
Dựa vào các phát biểu dưới đây, hãy xác định các nguyên tố là kim loại hay phi kim bằng cách đánh dấu ѵ vào ô trống, sau đó viết tên nguyên tố (kèm kí hiệu hóa học) vào bảng theo mẫu sau:
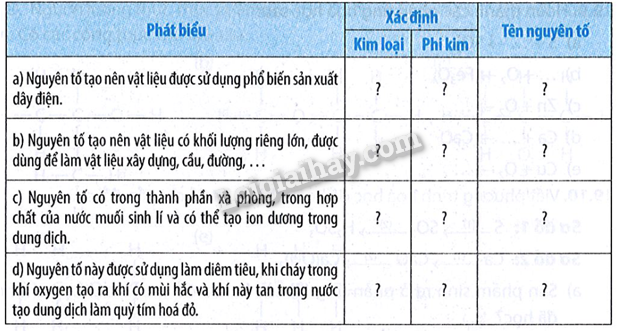
Phương pháp giải:
Sử dụng kiến thức về tính chất của kim loại và phi kim
Lời giải chi tiết:
a, kim loại-đồng
b, kim loại-sắt
c, kim loại-Sodium
d, phi kim-Photphorus
19.5
Có ý kiến cho rằng: “ Chỉ có kim loại mới có khả năng dẫn điện, phi kim thì không dẫn điện”. Theo em, ý kiến trên đúng không? Giải thích
Phương pháp giải:
Sử dụng tính chất vật lí của phi kim để giải thích
Lời giải chi tiết:
Ý kiến trên là không đúng. Đa số phi kim không dẫn điện do chúng tồn tại ở dạng phân tử. Nhưng có một số phi kim bị biến tính nên chúng có khả năng dẫn điện như là Carbon
19.6
Sắp xếp các ứng dụng dưới đây vào cột phù hợp với đơn chất phi kim đã cho vào bẳng theo mẫu sau đây:

(1) Làm điện cực trong pin.
(2) Điều chế thuốc diệt nấm mốc
(3) Chế tạo lõi lọc nước
(4) Khử trùng nước sinh hoạt
(5) Làm nguyên liệu để sản xuất acquy
(6) Nhiên liệu đốt trong công nghiệp
(7) Sản xuất phân bón
(8) Sản xuất diêm, thuốc súng và pháo hoa
Phương pháp giải:
liên hệ tính chất của phi kim với thực tiễn và ứng dụng
Lời giải chi tiết:
Carbon: 1,3
Sulfur: 2,7,8,6
Chlorine: 4,5
19.7
Vì sao người ta dùng chlorine để sản xuất chất tẩy rửa trong đời sống và trong công nghiệp?
Phương pháp giải:
Sử dụng tính chất hóa học của chlorine
Lời giải chi tiết:
Do chlorine có tính oxi hoá mạnh, diệt khuẩn nhanh lại có giá thành rẻ, dễ sản xuất.
19.8
Xác định ion dương, ion âm tạo thành khi hòa tan các chất sau vào nước:
a) KCl
b) NaNO 3
c) BaO
d) HCl
e) NaOH
Phương pháp giải:
Liên hệ tính chất hóa học của từng hợp chất.
Lời giải chi tiết:
a, Na + Cl -
b, Na + NO 3 -
c, Ba 2+ O 2-
d, H + Cl -
e, Na + OH -
19.9
Hoàn thành các phản ứng hóa học sau:
a) S + ... \( \to \) SO 2
b) ... + O 2 \( \to \) Fe 3 O 4
c) Zn + O 2 \( \to \) ...
d) Ca + ... \( \to \) CaO
e) Cu + O 2 \( \to \) ...
Phương pháp giải:
Sử dụng tính chất hóa học của kim loại và phi kim.
Lời giải chi tiết:
a) S + O 2 \( \to \) SO 2
b) 3Fe + 2O 2 \( \to \) Fe 3 O 4
c) Zn + O 2 \( \to \) ZnO
d) 2Ca + O 2 \( \to \) 2CaO
e) 2Cu + O 2 \( \to \) 2CuO
19.10
Viết phương trình hóa học để hoàn thành sơ đồ chuyển đổi sau
Sơ đồ 1: S \( \to \) SO 2 \( \to \) H 2 SO 3
Sơ đồ 2: Ca \( \to \)CaO \( \to \) Ca(OH) 2
a) Sản phẩm sinh ra ở phản ứng (2) của hai sơ đồ thuộc loại hợp chất nào đã học?
b) Xác định ion dương và ion âm cho hai sản phẩm sinh ra ở phản ứng (2) của hai sơ đồ trên
Phương pháp giải:
Sử dụng tính chất hóa học của phần đã học
Lời giải chi tiết:
Sơ đồ 1: S + O 2 \( \to \) SO 2
SO 2 + H 2 O \( \to \) H 2 SO 3
Sơ đồ 2: 2Ca + O 2 \( \to \) 2CaO
CaO + H 2 O \( \to \) Ca(OH) 2
a) Sản phẩm sinh ra ở phản ứng (2) của hai sơ đồ lần lượt là acid và base
b) Sơ đồ 1: H + và SO 3 2-
Sơ đồ 2: Ca 2+ và OH -