Lý thuyết bài 2: Thành phần của nguyên tử
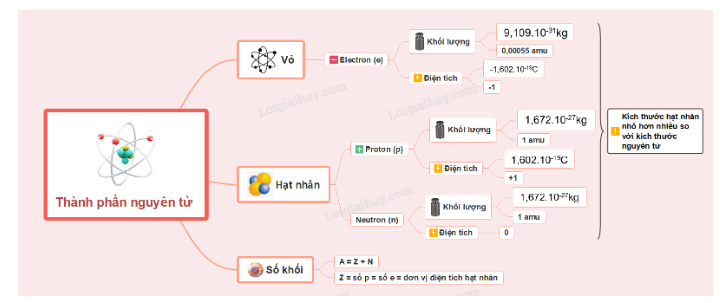
Nguyên tử thường được cấu tạo bởi 3 loại hạt cơ bản: neutron, electron, proton
Lý thuyết: Thành phần của nguyên tử
I. Thành phần cấu tạo nguyên tử
- Từ thời cổ Hy Lạp, nhà triết học Democritus cho rằng mọi vật chất được tạo thành từ các phần tử rất nhỏ
- Giữa thế kỉ XIX, các nhà khoa học cho rằng: các chất đều được cấu tạo nên từ những hạt rất nhỏ, không thể phân chia được nữa, gọi là nguyên tử.
- Cuối thế kỉ XIX, đầu XX, bằng những nghiên cứu thực nghiệm, các nhà khoa học đã chứng minh sự tồn tại của nguyên tử và nguyên tử có cấu tạo phức tạp.
II. Sự tìm ra electron
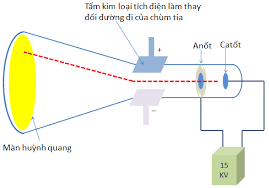
- Năm 1897, J.J.Thomson (người Anh) thực hiện phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron, electron là một thành phần của nguyên tử
III. Sự khám phá hạt nhân nguyên tử
- Năm 1911, E.Rutherford (người New Zealand) thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt α. Màn hình quang xung quanh lá vàng dùng để quan sát vị trí va chạm của hạt α. Hầu hết các hạt α đều xuyên qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước nhỏ so với kích thước nguyên tử
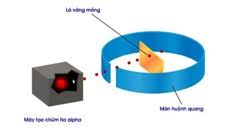
=> Nguyên tử có cấu tạo rỗng gồm hạt nhân ở trung tâm và lớp vở là các electron chuyển động xung quanh hạt nhân.
- Nguyên tử trung hòa về điện: Số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron của nguyên tử.
IV. Cấu tạo hạt nhân nguyên tử
- Năm 1918, E.Rutherford và các cộng sự dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton (mang điện tích dương, kí hiệu là p)
- Năm 1932, J.Chadwick (người Anh), cộng sự của Rutherford đã phát hiện ra hạt neutron (có khối lượng xấp xỉ hạt proton) khi bắn phá beryllium bằng các hạt α
- Hạt nhân (nucleus): ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện
V. Kích thước và khối lượng nguyên tử
1. Kích thước
- Đường kính nguyên tử gấp 10000 lần đường kính hạt nhân
Đơn vị thường sử dụng là Å
1nm = 10 -9 m
1 Å = 10 -10 m
1nm = 10Å
2. Khối lượng
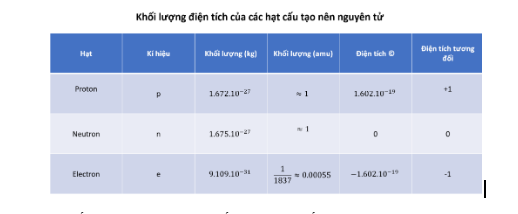
- Khối lượng của electron rất nhỏ nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân
- Khối lượng nguyên tử = m p + m n + m e ≈ = m p + m n (amu)