Bài 16. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học trang 98, 99, 100, 101, 102, 103, 104 Hóa 10 Chân trời sáng tạo
Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), 1. Tiến hành thí nghiệm 1 và quan sát hiện tượng của thí nghiệm. Nhận xét mối liên hệ giữa thể tích dung dịch Na2S2O3 với thời gian xuất hiện kết tủa
CH tr 98 MĐ
|
Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn (b), bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí(c),…
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên? |
Lời giải chi tiết:
(a) Ảnh hưởng của nhiệt độ
(b) Ảnh hưởng của áp suất
(c) Ảnh hưởng của nồng độ
CH tr 98 CH
|
1. Tiến hành thí nghiệm 1 và quan sát hiện tượng của thí nghiệm. Nhận xét mối liên hệ giữa thể tích dung dịch Na 2 S 2 O 3 với thời gian xuất hiện kết tủa |
Phương pháp giải:
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
Lời giải chi tiết:
Thể tích dung dịch Na 2 S 2 O 3 càng nhiều => Nồng độ Na 2 S 2 O 3 càng cao => Thời gian xuất hiện kết tủa càng nhanh
CH tr 99 CH
|
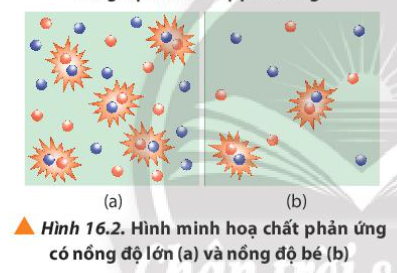
2. Quan sát Hình 16.2 và phương trình hóa học của phản ứng, giải thích kết quả thí nghiệm 1
|
Phương pháp giải:
Nồng độ cao => Mật độ các hạt chất tham gia cao => Tăng độ va chạm giữa các hạt chất tham gia
Lời giải chi tiết:
Khi nồng độ Na 2 S 2 O 3 cao => Các hạt phân tử Na 2 S 2 O 3 nhiều
=> Tăng sự va chạm giữa Na 2 S 2 O 3 và phân tử H 2 SO 4
=> Tăng khả năng tạo thành kết tủa
CH tr 99 LT
|
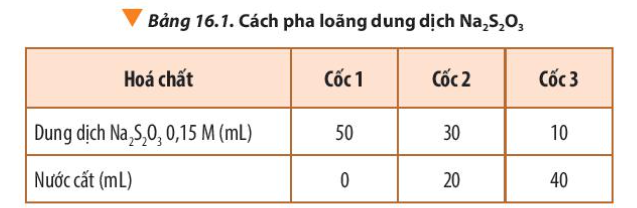
Giữ nguyên nồng độ dung dịch Na
2
S
2
O
3
ban đầu, pha loãng dung dịch H
2
SO
4
tương tự như cách pha loãng dung dịch Na
2
S
2
O
3
theo Bảng 16.1, kết quả thí nghiệm sẽ thay đổi thế nào?
|
Phương pháp giải:
Nồng độ H 2 SO 4 giảm => Tốc độ phản ứng giảm
Lời giải chi tiết:
Khi pha loãng dung dịch H 2 SO 4
=> Nồng độ H 2 SO 4 giảm
=> Tốc độ phản ứng giảm
CH tr 99 CH
|
3. Quan sát Hình 16.3, nhận xét sự ảnh hưởng của nhiệt độ đến tốc độ phản ứng
|
Lời giải chi tiết:
Khi tăng nhiệt độ, tốc độ phản ứng tăng
CH tr 100 CH
|
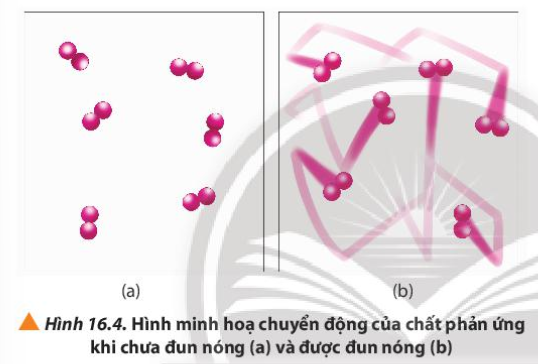
4. Quan sát Hình 16.4 và phương trình hóa học của phản ứng, giải thích vì sao tốc độ mất màu của KMnO 4 trong 2 cốc không giống nhau
|
Phương pháp giải:
Khi tăng nhiệt độ, các chất chuyển động với tốc độ lớn
Lời giải chi tiết:
- Cốc (2) ở nhiệt độ thường, các hạt KMnO 4 , H 2 C 2 O 4 và H 2 SO 4 chuyển động với tốc độ nhỏ, khả năng va chạm ít => Phản ứng diễn ra chậm => Lâu mất màu
- Cốc (1) ở nhiệt độ cao, các hạt KMnO 4 , H 2 C 2 O 4 và H 2 SO 4 chuyển động với tốc độ lớn, khả năng va chạm cao => Phản ứng diễn ra nhanh => Nhanh mất màu
CH tr 100 LT
|
Biết rằng, khi nhiệt độ tăng thêm 10 o C, tốc độ của một phản ứng hóa học tăng 4 lần; cho biết tốc độ phản ứng giảm bao nhiêu lần khi nhiệt độ giảm từ 70 o C xuống 40 o C |
Phương pháp giải:

Lời giải chi tiết:

CH tr 101 CH
|
5.
Quan sát Hình 16.5, cho biết mật độ phân bố của các phân tử chất khí trong bình kín thay đổi như thế nào khi tăng áp suất của bình?
|
Phương pháp giải:
Quan sát Hình 16.5 và rút ra nhận xét
Lời giải chi tiết:
Khi tăng áp suất của bình, mật độ phân bố của các phân tử chất khí trong bình kín tăng
CH tr 101 LT
|
Xét các phản ứng xảy ra trong bình kín: 2CO(g) + O 2 (g) → 2CO 2 (g) (1) NH 4 Cl(s) → NH 3 (g) + HCl(g) (2) Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng nào? Khi tăng áp suất, tốc độ phản ứng thay đổi như thế nào? |
Lời giải chi tiết:
- Trong phản ứng hóa học có sự tham gia của chất khí, áp xuất sẽ ảnh hưởng đến tốc độ phản ứng
=> Yếu tố áp suất ảnh hưởng đến tốc độ phản ứng (1)
- Khi tăng áp suất, tốc độ phản ứng tăng
CH tr 101 CH
|
6. Tiến hành thí nghiệm 2 và so sánh tốc độ khí thoát ra trong hai bình tam giác |
Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải chi tiết:
Tốc độ khí thoát ra ở bình 2 nhanh hơn bình 1
CH tr 101 CH
|
7. Nhận xét mối liên hệ giữa tốc độ phản ứng với kích thước của CaCO 3 |
Lời giải chi tiết:
Kích thước các hạt CaCO 3 càng nhỏ thì tốc độ phản ứng càng nhanh
CH tr 102 CH
|
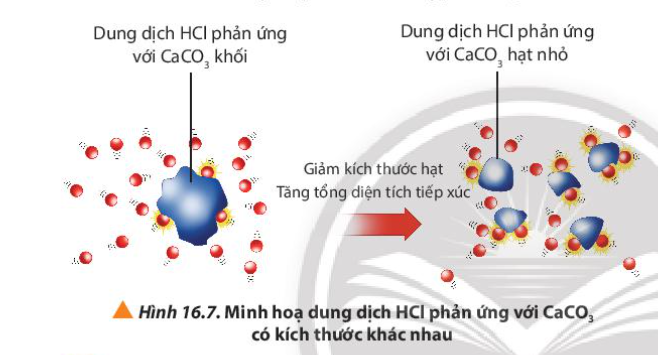
8. Quan sát Hình 16.7, giải thích kết quả của thí nghiệm 2
|
Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải chi tiết:
- Ở bình 2, CaCO 3 ở dạng hạt nhỏ
=> Tổng diện tích tiếp xúc giữa CaCO 3 với HCl tăng
=> Tốc độ phản ứng bình 2 tăng
=> Tốc độ khí thoát ra ở bình 2 nhanh hơn
CH tr 102 LT
|
Củi khi được chẻ nhỏ sẽ cháy nhanh hơn và mạnh hơn so với củi có kích thước lớn. Giải thích |
Phương pháp giải:
Khi củi được chẻ nhỏ, tổng diện tích tiếp xúc của củi với oxygen tăng
Lời giải chi tiết:
- Khi củi được chẻ nhỏ => Tổng diện tích tiếp xúc của củi với oxygen tăng
- Mà oxygen duy trì sự cháy
=> Tăng tốc độ cháy của củi
=> Củi sẽ cháy nhanh hơn và mạnh hơn
CH tr 102 CH
|
9. Tiến hành thí nghiệm 3, quan sát hiện tượng và so sánh sự thay đổi của tàn đóm ở 2 ống nghiệm |
Lời giải chi tiết:
- Hiện tượng: Tàn đóm ở ống nghiệm (1) cháy le lói, tàn đóm ở ống nghiệm (2) bùng cháy
=> Tàn đóm ở ống nghiệm (2) cháy mạnh hơn
CH tr 103 LT
|
Tại sao khi nhai kĩ cơm, cảm nhận cơm có vị ngọt hơn |
Phương pháp giải:
Chất xúc tác làm tăng tốc độ của phản ứng hóa học
Lời giải chi tiết:
Khi ta nhai cơm lâu trong miệng thấy có cảm giác ngọt vì tinh bột trong cơm đã chịu tác dụng của enzim amilaza trong nước bọt và biến đổi một thành phần thành đường mantôzơ, đường này đã tác động vào các gai vị giác trên lưỡi cho ta cảm giác ngọt.
CH tr 103 CH
|
10.
Quan sát Hình 16.9, cho biết yếu tố nào ảnh hưởng đến tốc độ phản ứng đã được vận dụng trong thực tiễn
|
Phương pháp giải:
a) Ảnh hưởng của nồng độ
b) Ảnh hưởng của áp suất
c) Ảnh hưởng của diện tích tiếp xúc
d) Ảnh hưởng của nhiệt độ
Lời giải chi tiết:
a) Ảnh hưởng của nồng độ: Dùng bình chứa oxygen có nồng độ oxygen cao hơn không khí => Phản ứng cháy dễ dàng xảy ra
b) Ảnh hưởng của áp suất: Dùng nồi áp suất làm tăng áp suất trong nồi => Thực phẩm trong nồi áp suất sẽ nhanh chín hơn
c) Ảnh hưởng của diện tích tiếp xúc: Đậy nắp lò làm hạn chế diện tích tiếp xúc của than với oxygen trong không khí => Phản ứng cháy diễn ra chậm => Giữ than cháy được lâu hơn
d) Ảnh hưởng của nhiệt độ: Khi để thức ăn trong tủ lạnh => Nhiệt độ bị giảm => Kìm hãm phản ứng oxi hóa thức ăn => Thức ăn sẽ lâu bị ôi thiu
CH tr 104 VD
|
Trong quá trình lên men giấm, người ta thường cho chuối hay nước dừa vào lọ chứa giấm nuôi, giải thích |
Lời giải chi tiết:
Trong quá trình lên men giấm, người ta thường cho chuối hay nước dừa vào giúp tăng mùi thơm của giấm và kích thích con giấm lên men nhanh hơn vì con giấm sử dụng đường làm thức ăn.
CH tr 104 BT1
|
Bài 1:
Hai nhân vật minh họa trong hình bên đang chế biến món gà rán, được thực hiện bằng hai cách. Một người chọn cách chia ra từng phần nhỏ, người còn lại chọn cách để nguyên, giả thiết các điều kiện đều giống nhau (nhiệt độ, lượng dầu ăn,…) Hãy cho biết cách nào món ăn nhanh chín hơn? Giải thích
|
Phương pháp giải:
Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
Lời giải chi tiết:
Khi chia con gà thành các phần nhỏ thì món ăn sẽ nhanh chín hơn. Vì khi chia nhỏ, tổng diện tích tiếp xúc của con gà với chảo nóng nhiều hơn => Tốc độ chín thức ăn nhanh hơn
CH tr 104 BT2
| Bài 2: Nồng độ, nhiệt độ, áp suất, diện tích tiếp xúc, chất xúc tác ảnh hưởng như thế nào đến tốc độ phản ứng |
Lời giải chi tiết:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất lượng khi kết thúc phản ứng
CH tr 104 BT3
|
Bài 3: Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau: Zn(s) + 2HCl(aq) → ZnCl 2 (aq) + H 2 (g) Tốc độ khí H 2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây a) Thay a g Zn hạt bằng a g bột Zn b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl |
Phương pháp giải:
a) Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
b) Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
c) Khi tăng nhiệt độ, tốc độ phản ứng tăng
Lời giải chi tiết:
a) Khi thay a g hạt Zn = a g bột Zn
=> Chất tham gia được nghiền nhỏ
=> Diện tích bề mặt tiếp xúc của Zn với HCl tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn
b) Khi thay dung dịch HCl 2 M = dung dịch HCl 1 M
=> Nồng độ chất tham gia giảm
=> Tốc độ phản ứng giảm
=> Khí thoát ra chậm hơn
c) Khi đun nóng nhẹ dung dịch HCl
=> Nhiệt độ của phản ứng tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn
CH tr 104 BT4
|
Bài 4: Cho phương trình hóa học của phản ứng: 2CO(g) + O 2 (g) → 2CO 2 (g) Nếu hệ số nhiệt độ Van’t Hoff bằng 2, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng từ 30 o C lên 60 o C? |
Phương pháp giải:

Lời giải chi tiết: