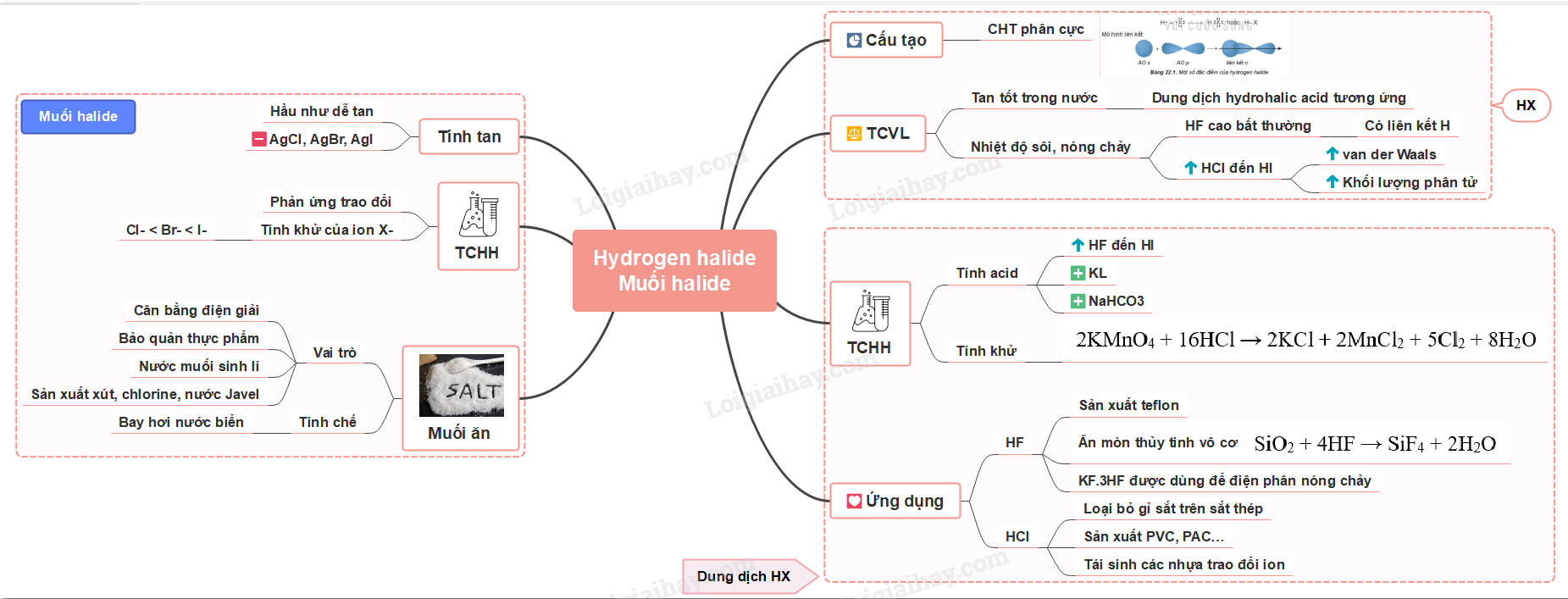
Lý thuyết bài 22: Hydrogen halide - Muối halide
xu hướng biến đổi nhiệt độ sôi hydrogen halide, biến đổi tính acid, ứng dụng, nhận biết ion halide
Lý thuyết: Hydrogen halide - Muối halide
I. Hydrogen halide
1. Cấu tạo phân tử
- Phân tử HX gồm 1 liên kết cộng hóa trị phân cực
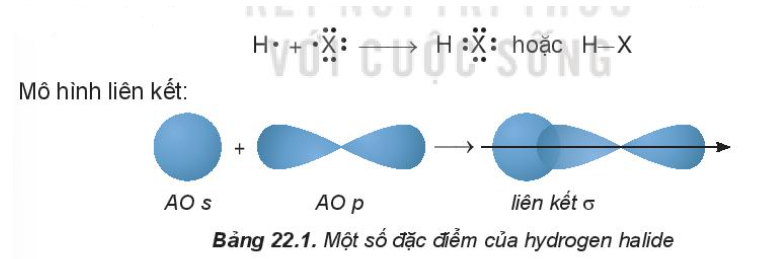
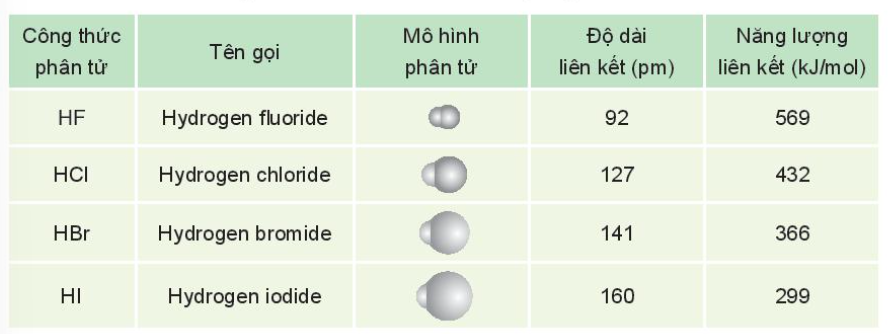
2. Tính chất vật lí
- Ở điều kiện thường, HX tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng
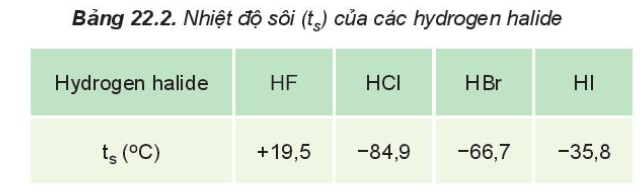
- HF có nhiệt độ sôi cao bất thường là do HF có khả năng tạo liên kết hydrogen
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
II. Hydrohalic acid
1. Tính chất hóa học
a) Tính acid
- Từ HF đến HI, tính acid tăng dần
- Tác dụng với kim loại
Zn + 2HCl → ZnCl 2 + H 2
- Tác dụng với muối NaHCO 3
HCl + NaHCO 3 → NaCl + CO 2 + H 2 O
b) Tính khử
- Ngoài tính acid, HX còn có tính khử.
Ví dụ:
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 5Cl 2 + 8H 2 O
2. Ứng dụng
a) HF
- Sản xuất teflon (chất chống dính ở nồi, chảo) theo sơ đồ

- Ăn mòn thủy tinh vô cơ
SiO 2 + 4HF → SiF 4 + 2H 2 O
- Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy, sản xuất F 2
b) HCl
- Loại bỏ gỉ sắt trên sắt thép trước khi chuyển sang công đoạn sản xuất tiếp theo
- Sản xuất hợp chất vô cơ và hữu cơ: PVC, PAC…
- Tái sinh các nhựa trao đổi ion nhừm thay thế các ion Na + và Ca 2+ = ion H +
III. Muối halide
1. Tính tan
- Hầu như dễ tan trong nước trừ AgCl, AgBr, AgI
2. Tính chất hóa học
a) Phản ứng trao đổi
- X - tác dụng với AgNO 3 (nhận biết X - )
NaF + AgNO 3 → Không phản ứng
NaCl + AgNO 3 → NaNO 3 + AgCl↓ trắng
NaBr + AgNO 3 → NaNO 3 + AgBr↓ vàng nhạt
NaI + AgNO 3 → NaNO 3 + AgI↓ vàng
b) Tính khử của ion X -
2NaBr + 3H 2 SO 4 → 2NaHSO 4 + Br 2 + SO 2 + 2H 2 O
8NaI + 9H 2 SO 4 → 8NaHSO 4 + 4I 2 + H 2 S + 4H 2 O
- NaCl chỉ xảy ra phản ứng trao đổi thành HCl
- Tính khử của các ion halide tăng dần theo thứ tự: Cl - < Br - < I -
3. Muối ăn
a) Vai trò của muối ăn
- Cân bằng điện giải, truyền dẫn xung điện thần kinh, trao đổi chất,…
- Bảo quản thực phẩm (ướp, muối),…
- Nước muối sinh lí, nước nhỏ mắt, dịch tiêm truyền tĩnh mạch,…
- Sản xuất xút, chlorine, nước Javel,…
b) Tinh chế muối ăn
- Kết tinh nhờ quá trình làm bay hơi nước biển dưới sức nóng của Mặt Trời
- Để thu được muối tinh khiết, cần phải kết tinh lại
Sơ đồ tư duy