Lý thuyết bài 4: Sơ lược bảng tuần hoàn các nguyên tố hóa học - KHTN 7 Chân trời sáng tạo
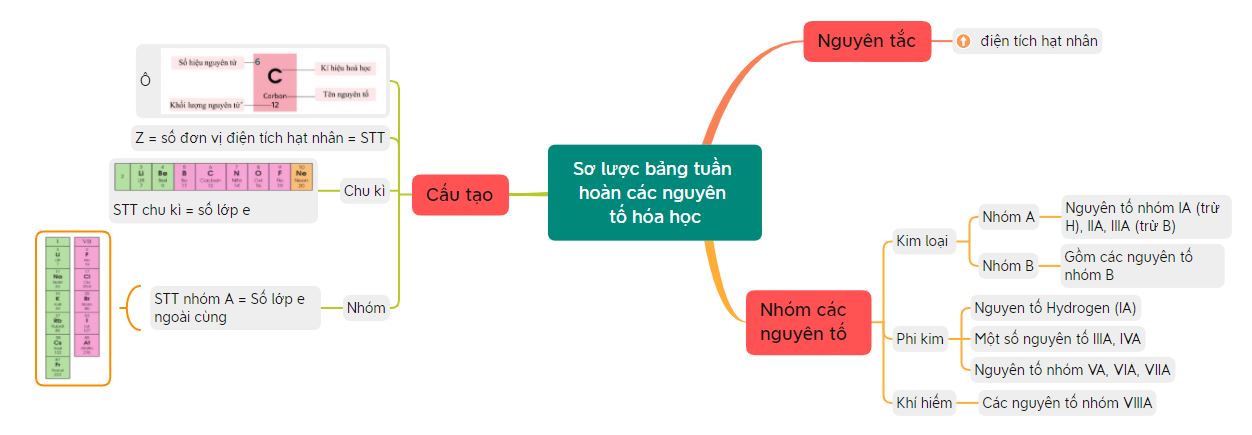
Sơ lược về bảng tuần hoàn các nguyên tố hóa học: ô nguyên tố, chu kì, nhóm
Lý thuyết: Sơ lược bảng tuần hoàn các nguyên tố hóa học
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
- Cơ sở chính để sắp xếp các nguyên tố hóa học vào bảng tuần hoàn các nguyên tố hóa học là dựa vào điện tích hạt nhân nguyên tử
- Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
+ Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Cấu tạo bảng tuần hoàn các nguyên tố hóa học
- Đặc trưng của bảng tuần hoàn là: ô nguyên tố, chu kì, nhóm
- Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn
Ô nguyên tố trong bảng tuần hoàn các nguyên tố hóa học
- Mỗi nguyên tố hoá học được sắp xếp vào một ô của bảng tuần hoàn, được gọi là ô nguyên tố.
Ví dụ 1:
Ô nguyên tố carbon cung cấp các thông tin về nguyên tử carbon.
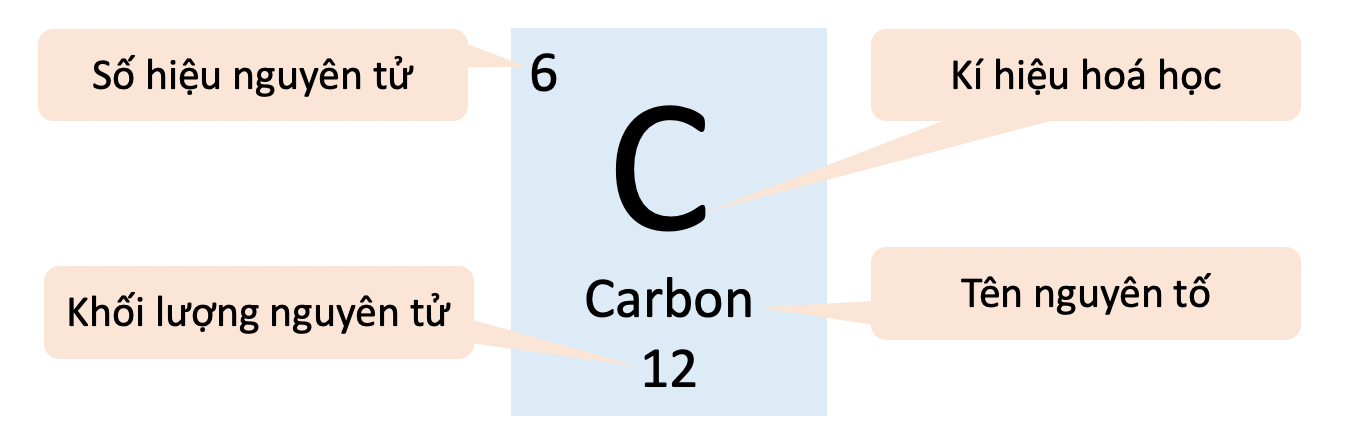
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (Z).
+ Kí hiệu hoá học.
+ Tên nguyên tố.
+ Khối lượng nguyên tử.
- Số hiệu nguyên tử (Z) = số đơn vị điện tích hạt nhân = số electron trong nguyên tử = số thứ tự của nguyên tố trong bảng tuần hoàn.
Chu kì trong bảng tuần hoàn các nguyên tố hóa học
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được sắp xếp thành hàng theo điện tích hạt nhân tăng dần từ trái qua phải.
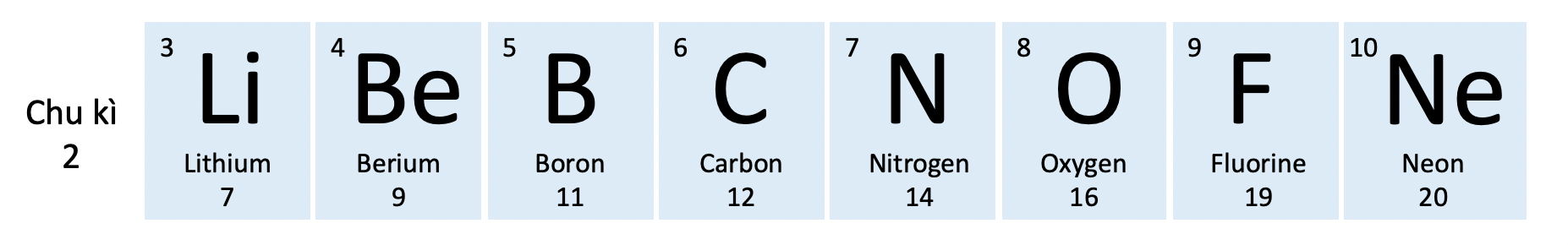 Chu kì 2 trong bảng tuần hoàn các nguyên tố hoá học
Chu kì 2 trong bảng tuần hoàn các nguyên tố hoá học
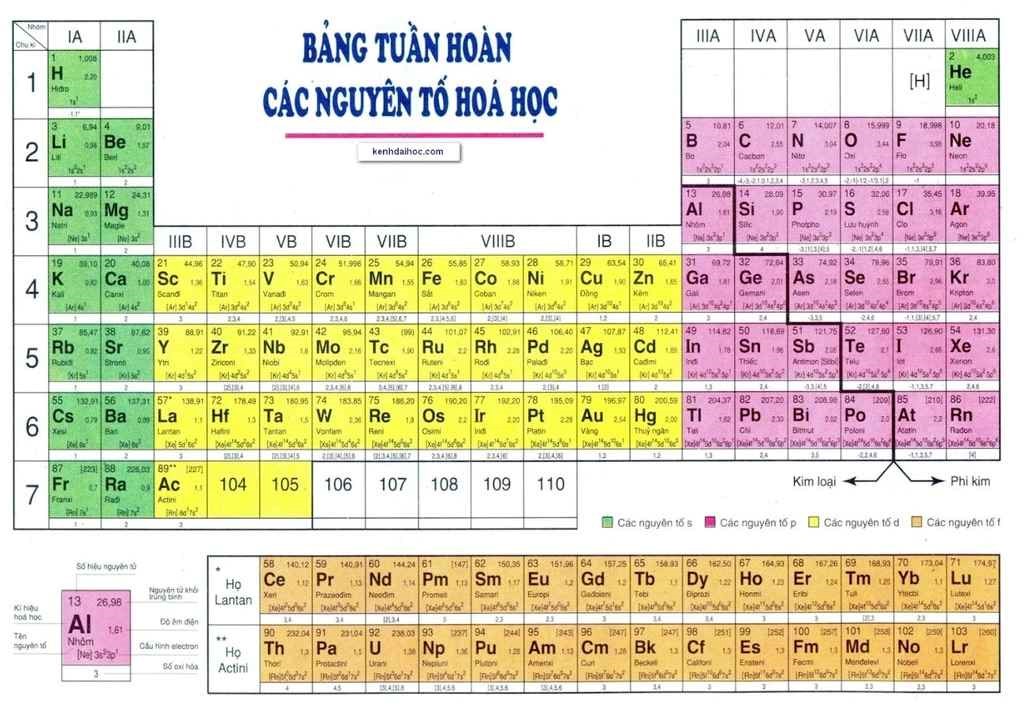
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ 1 đến 7.
- Chu kì 1, 2, 3 được gọi là là các chu kì nhỏ, chu kì 4, 5, 6, 7 được gọi là là các chu kì lớn.
Ví dụ 2: Chu kì 1 gồm hai nguyên tố H và He, chu kì 2 gồm 8 nguyên tố từ Li đến Ne, chu kì 3 gồm 8 nguyên tố từ Na đến Ar
Nhóm trong bảng tuần hoàn các nguyên tố hóa học
- Bảng tuần hoàn gồm 8 nhóm A được đánh số từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
- Các nguyên tố trong cùng một nhóm A có số electron lớp ngoài cùng giống nhau, do đó chúng có tính chất hoá học tương tự nhau.
- Trong cùng một nhóm, khi đi từ trên xuống dưới, điện tích hạt nhân tăng dần.
- Số thứ tự của nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của nguyên tố thuộc nhóm đó.
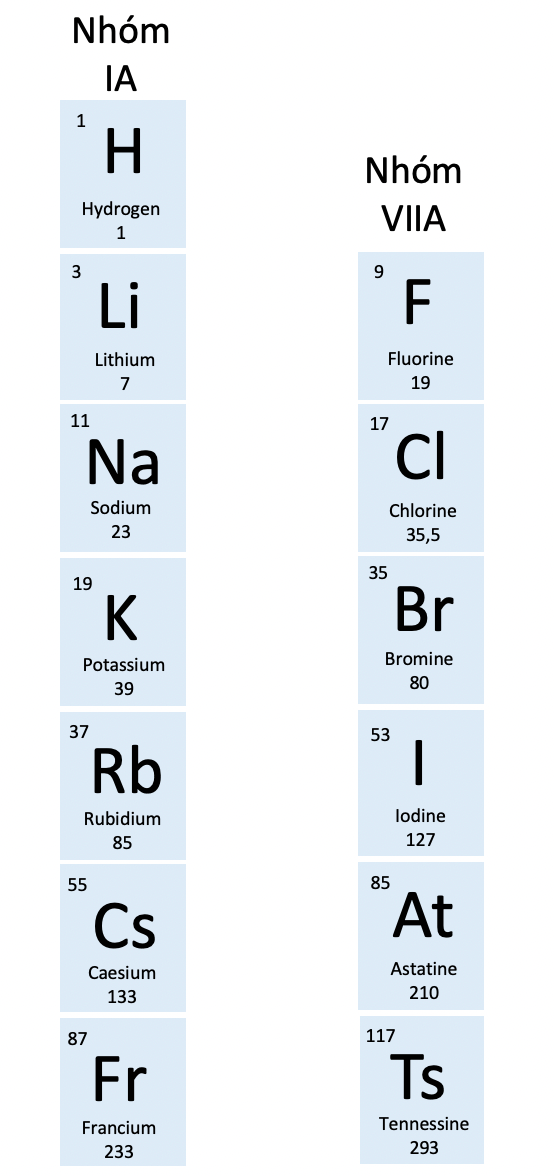
Nhóm IA và VIIA trong bảng tuần hoàn
3. Các nguyên tố kim loại
Nguyên tố kim loại nhóm A
- Các nguyên tố kim loại nhóm A gồm nhóm IA (trừ nguyên tố H), nhóm IIA, nhóm IIIA (trừ nguyên tố B),…
- Các nguyên tố kim loại thuộc nhóm IA được gọi là nhóm kim loại kiềm

- Các nguyên tố kim loại thuộc nhóm IIA được gọi là nhóm kim loại kiềm thổ

Các nguyên tố kim loại nhóm B
- Các nguyên tố nhóm B đều là kim loại, mỗi nhóm B tương ứng với một cột trong bảng tuần hoàn
4. Các nguyên tố phi kim
- Nhóm nguyên tố phi kim chủ yếu tập trung ở góc bên phải của bảng tuần hoàn các nguyên tố hóa học
+ Nguyên tố H ở nhóm IA
+ Một số nguyên tố nhóm IIIA và IVA
+ Hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA
- Ở điều kiện thường, chúng có thể ở thể rắn, thể lỏng hay thể khí.
5. Nhóm các nguyên tố khí hiếm
- Trong số 118 nguyên tố hoá học đã biết có 7 nguyên tố là nguyên tố khí hiếm.
- Nguyên tử của chúng có lớp electron ngoài cùng bền vững nên khó bị biến đổi hoá học.
- Nguyên tố khí hiếm nằm ở nhóm VIIIA trong bảng tuần hoàn.
Sơ đồ tư duy