Lý thuyết bài 6: Giới thiệu về liên kết hóa học - KHTN 7 Kết nối tri thức
Giới thiệu về liên kết hóa học: Liên kết ion, liên kết cộng hóa trị
Lý thuyết: Giới thiệu về liên kết hóa học
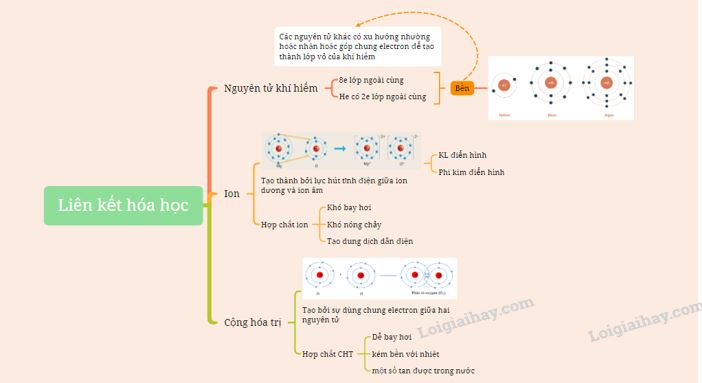
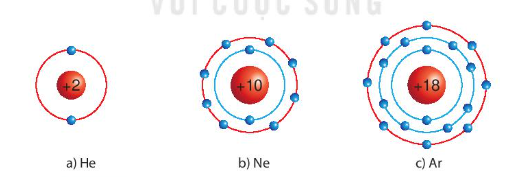
I. Cấu trúc electron bền vững của khí hiếm
- Nguyên tử khí hiếm có 8 electron ở lớp vỏ ngoài cùng (trừ He có 2 electron) và là lớp vỏ bền vững
=> Các nguyên tử khí hiếm không tham gia liên kết ở điều kiện thường
- Các nguyên tử khác có lớp vỏ ngoài cùng kém bền có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác
II. Liên kết ion
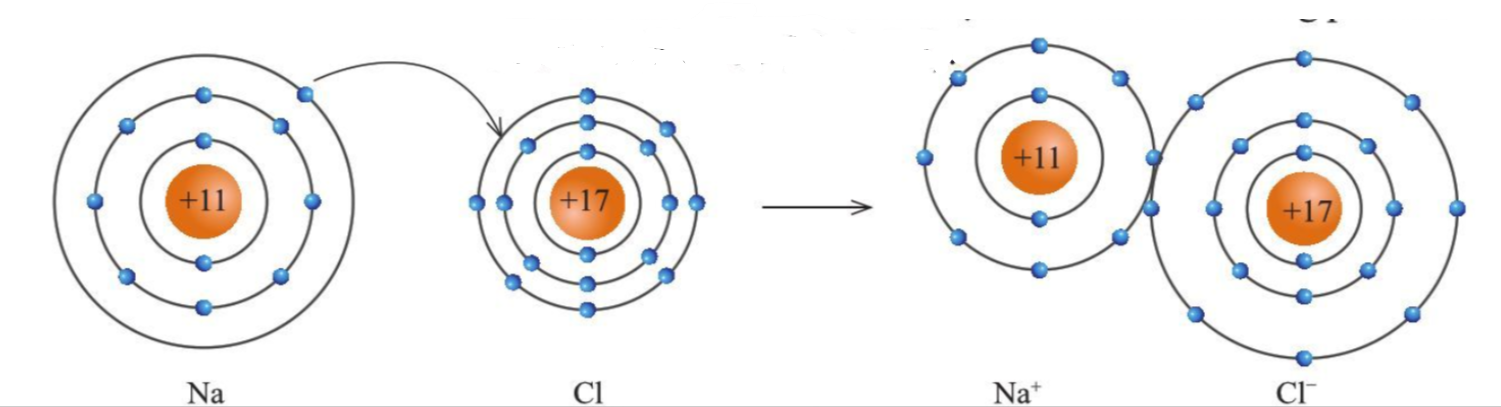
Sự hình thành liên kết ion trong phân tử muối ăn
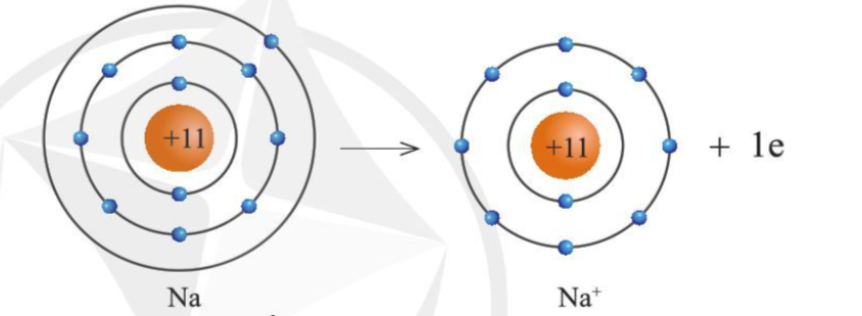
- Khi Na kết hợp với Cl để tạo thành NaCl
+ Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích +1 (Na + ) có vỏ bền vững giống vỏ nguyên tử khí hiếm Ne
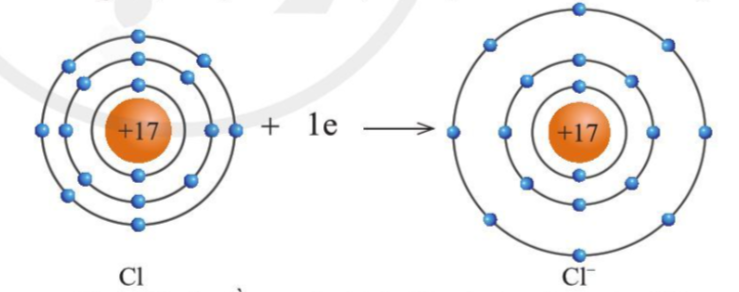
+ Nguyên tử Cl nhận thêm 1 electron từ nguyên tử Na trở thành ion mang điện tích -1 thành (Cl - ) có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar
+ 2 ion Na + và Cl - hút nhau tạo thành NaCl

- Tính chất của hợp chất ion:
+ Chất rắn ở điều kiện thường
+ Khó bay hơi, khó nóng chảy
+ Khi tan trong nước tạo thành dung dịch dẫn được điện
III. Liên kết cộng hóa trị
1. Liên kết cộng hóa trị trong phân tử đơn chất
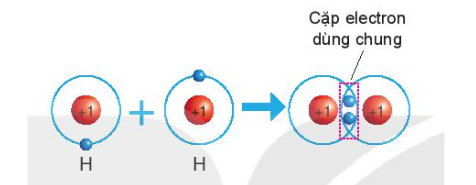
Sự hình thành phân tử hydrogen
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm
=> Khi 2 nguyên tử H liên kết với nhau, mỗi nguyên tử góp 1 electron => đôi electron dùng chung
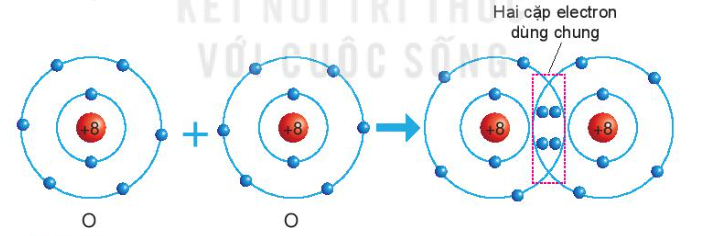
Sự hình thành phân tử oxygen
- Nguyên tử O có 6 electron ở lớp ngoài cùng và cần thêm 2 electron để có lớp vỏ bền vững tương tự khí hiếm
=> Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử góp 2 electron => 2 đôi electron dùng chung

2. Liên kết cộng hóa trị trong phân tử hợp chất
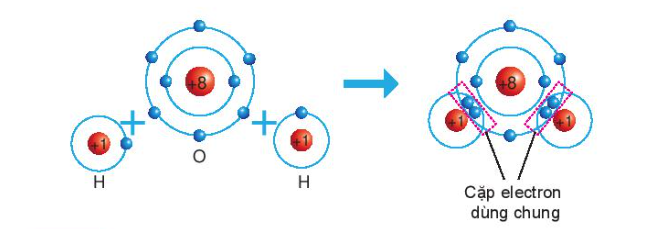
Sự hình thành phân tử nước
- Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron
=> 2 cặp electron dùng chung.
=> Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước
- Tính chất của hợp chất cộng hóa trị:
+ Có thể là chất khí, chất lỏng hay chất rắn
+ Nhiệt độ nóng chảy, nhiệt độ sôi thấp
+ Không dẫn điện khi tan trong nước
Sơ đồ tư duy: