Lý thuyết Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch - Hóa 12 Chân trời sáng tạo
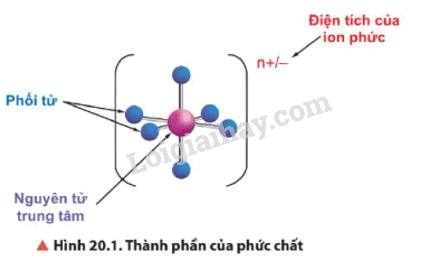
Trong phức chất có nguyên tử trung tâm (còn gọi là nhân trung tâm) và phối tử.
1. Thành phần và dạng hình học của phức chất
- Trong phức chất có nguyên tử trung tâm (còn gọi là nhân trung tâm) và phối tử. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho – nhận, trong đó phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
Ví dụ: phức chất [Cr(NH 3 ) 6 ] 3+ có nguyên tử trung tâm là Cr 3+ và phối tử là NH 3
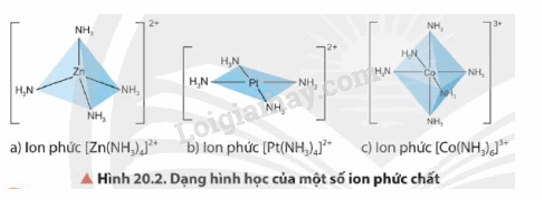
- Dạng hình học của phức chất phổ biến là tứ diện, vuông phẳng và bát diện
2. Sự hình thành phức chất trong dung dịch
- Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (M n+ ) thường nhận các cặp electron hóa trị riêng từ các phân tử H 2 O để hình thành các liên kết cho – nhận, tạo ra phức chất aqua theo phương trình hóa học tổng quát sau:;
M n+ (aq) + m H 2 O(l) \( \to \) [M(OH 2 ) m ] n+ (aq)
Với: n là giá trị điện tích của cation kim loại M
m là số phối tử H 2 O
[M(OH 2 ) m ] n+ là công thức tổng quát của phức chất aqua của M n+ .
- Phản ứng thay thế phối tử trong phức chất
Ở những điều kiện phù hợp, các anion và phân tử như OH - , X - (halide), NH 3 ,…. Có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất
Ví dụ: [Cr(OH 2 ) 6 ] 3+ (aq) + 6OH - (aq) \( \to \) [Cr(OH) 6 ] 3- (aq) + 6H 2 O(l)
- Dấu hiệu của phản ứng tạo phức chất trong dung dịch
Các phản ứng tạo phức chất thường có một số dấu hiệu dễ quan sát như sự biến đổi máu sắc, sự hòa tan, sự kết tủa. Trong các dấu hiệu trên, sự biến đổi màu sắc là phổ biến hơn cả
- Phản ứng thay thế phối tử trong phức chất
Ở những điều kiện phù hợp, các anion và phân tử như OH - , X - (halide), NH 3 ,…. Có thể thay thế được một, một số hoặc tất cả các phối tử trong phức chất
Ví dụ: [Cr(OH 2 ) 6 ] 3+ (aq) + 6OH - (aq) \( \to \) [Cr(OH) 6 ] 3- (aq) + 6H 2 O(l)
3. Một số ứng dụng của phức chất
- Phức chất có nhiều ứng dụng trong lĩnh vực, như y họcc, dược hóa, hóa học,…
- Phức chất có ý nghĩa to lớn trong ngành y học và dược học. Nhiều dẫn xuất có hoạt tính sinh học trên cơ thể người là phức chất của các kim loại như Cu, Zn, Co, Pt, Au,… Đây là cơ sở cho việc sản xuất thuốc chữa bệnh.
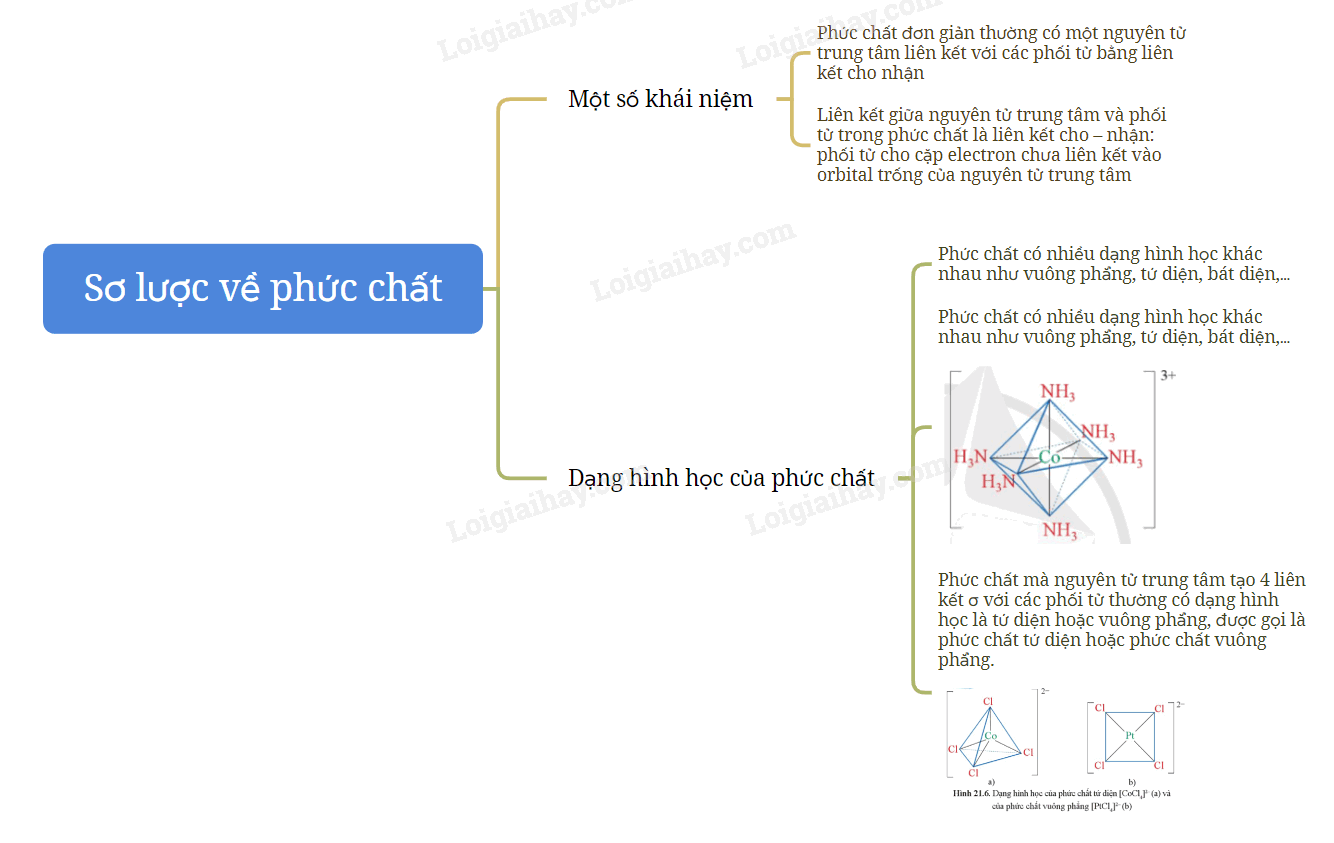
SƠ ĐỒ TƯ DUY