Lý thuyết Tính chất vật lí và tính chất hóa học của kim loại - Hóa 12 Kết nối tri thức
Kim loại có tính dẻo:
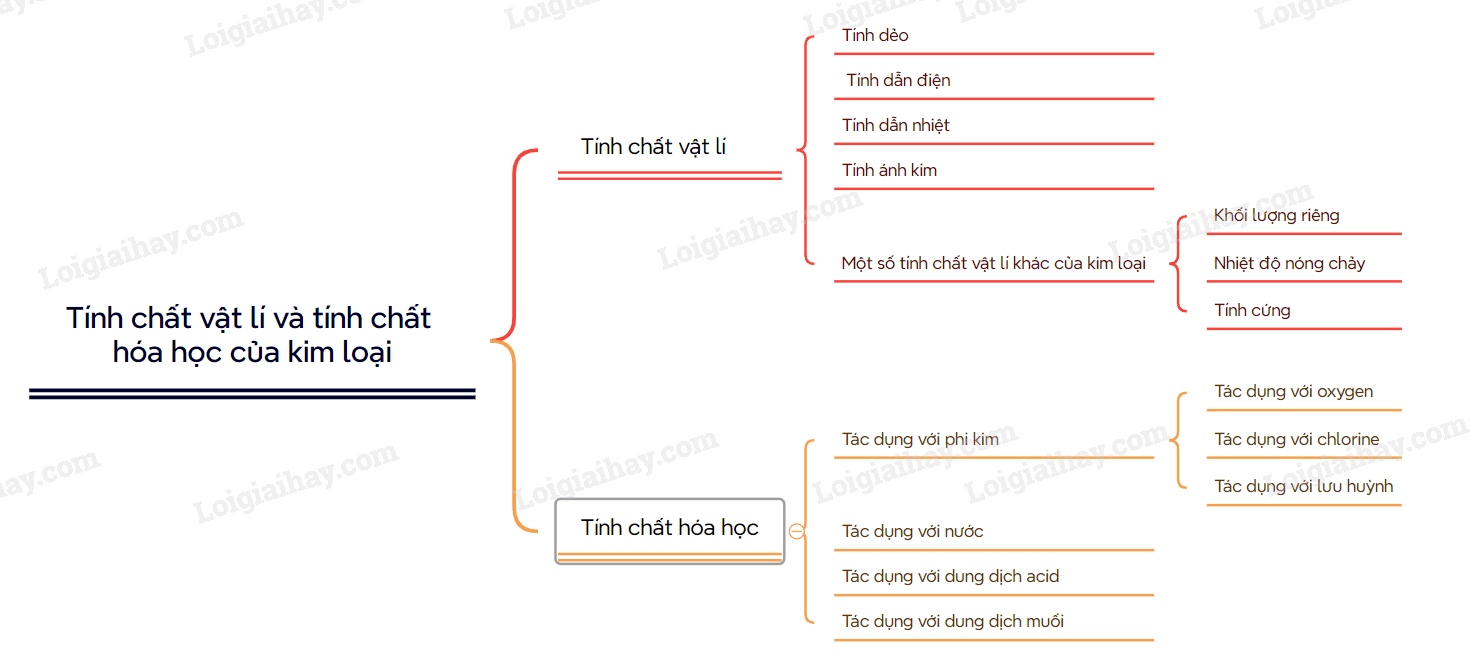
I. Tính chất vật lí
1. Tính dẻo
Kim loại có tính dẻo: dễ rèn, dễ dát mỏng và dễ kéo sợi. Nhờ có tính dẻo mà kim loại có thể được uốn cong, ép khuôn thành nhiều hình dạng và kích thước khác nhau.
2. Tính dẫn điện
Tất cả các kim loại đều có tính dẫn điện.
3. Tính dẫn nhiệt
Tính dẫn nhiệt của các kim loại cũng được giải thích bằng sự có mặt của các electron tự do trong mạng tinh thể. Các kim loại dẫn điện tốt thường dẫn nhiệt tốt. Do có tính dẫn nhiệt tốt, các kim loại hoặc hợp kim được sử dụng làm các dụng cụ đun nấu như xoong, nồi, chảo,…
4. Tính ánh kim
Các elctron tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng nhìn thấy được. Do đó, kim loại có vẻ sáng lấp lánh, gọi là ánh kim
5. Một số tính chất vật lí khác của kim loại
a) Khối lượng riêng
Khối lượng riêng của các kim loại rất khác nhau. Kim loại nhẹ nhất là lithium, kim loại nặng nhất là osium. Kim loại có D < 5g/cm3, được gọi là kim loại nhẹ, những kim loại có D > 5g/cm3, được gọi là kim loại nặng.
b) Nhiệt độ nóng chảy
Nhiệt độ nóng chảy của các kim loại biến đổi trong khoảng rộng: có kim loại nóng chảy ở nhiệt độ rất cao như tungsten (W), kim loại duy ở trạng thái lỏng trong điều kiện thường là thủy ngân.
c) Tính cứng
Các kim loại có độ cứng rất khác nhau. Kim loại cứng nhất là Cr, có thể cắt được kính, các kim loại mềm nhất là kim loại kiềm như potassium, rubidium, sodium.
II. Tính chất hóa học
1. Tác dụng với phi kim
a) Tác dụng với oxygen
Hầu hết các kim loại (trừ vàng, bạc, platinum,…) đều tác dụng với oxygen tạo thành oxide.
Ví dụ: \(4{\rm{A}}l(s) + 3{O_2}(g) \to 2{\rm{A}}{l_2}{O_3}(s)\)
b) Tác dụng với chlorine
Hầu hết các kim loại đều tác dụng với khí chlorine khi đun nóng, thu được muối chloride tương ứng.
Ví dụ: 2Fe(s) + 3Cl 2 (g) \( \to \)2FeCl 3 (s)
c) Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh khi đun nóng (trừ thủy ngân phản ứng ngay ở nhiệt độ thường)
Ví dụ:
2. Tác dụng với nước
Hầu hết các kim loại nhóm IA, IIA có tính khử mạnh, tác dụng với nước ở nhiệt độ thường giải phóng H 2 .
Ví dụ: 2Na(s) + H 2 O(l) \( \to \)2NaOH(aq) + H 2 (g)
Những kim loại có thế điện cực chuẩn \(E_{{M^{n + }}/M}^o < - 0,414V\)
3. Tác dụng với dung dịch acid
a) Với dung dịch HCl, H 2 SO 4 loãng
Ở điều kiện chuẩn, những kim loại có \(E_{{M^{n + }}/M}^o < 0V\)có thể tác dụng với các dung dịch acid như HCl, H 2 SO 4 tạo thành H 2
Ví dụ: Zn(s) + 2H + (aq) \( \to \) Zn 2+ (aq) + H 2 (g)
b) Với dung dịch H 2 SO 4 đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: Cu(s) + 2H 2 SO 4 (aq) đặc\( \to \)CuSO 4 (aq) + SO 2 (g) + 2H 2 O(l)
4. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của nó.
Ví dụ: Zn(s) + CuSO 4 (aq) \( \to \) ZnSO 4 (aq) + Cu(s)
SƠ ĐỒ TƯ DUY