Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất trang 135, 136, 137 Hóa 12 Cánh diều
Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố Sc
CH tr 135
Trả lời câu hỏi Mở đầu trang 135 SGK Hóa 12 Cánh diều
Kim loại chuyển tiếp dãy thứ nhất gồm 9 nguyên tố Sc (Z=21) đến Cu (Z=29) trong bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố này thường thể hiện nhiều trạng thái oxi hóa khác nhau. Chẳng hạn, nguyên tố sắt (Z=26) có số oxi hóa +2 trong hợp chất FeCl 2 có số oxi hóa +3 trong hợp chất FeCl 3 .
a) Vì sao kim loại chuyển tiếp dãy thứ nhất thường tạo được nhiều hợp chất với các số oxi hóa dương khác nhau?
b) Nêu một số tính chất và ứng dụng của đơn chất kim loại chuyển tiếp dãy thứ nhất.
Phương pháp giải:
Dựa vào cấu hình electron của kim loại chuyển tiếp.
Lời giải chi tiết:
a) Do có nhiều electron hóa trị, đồng thời có độ âm điện nhỏ nên nguyên tử của nguyên tố kim loại chuyển tiếp thể hiện nhiều số oxi hóa dương khác nhau.
b) Tính chất: có nhiệt độ nóng chảy, khối lượng riêng và độ cứng cao.
Ứng dụng: tạo các hợp kim
CH tr 136
Trả lời câu hỏi trang 136 SGK Hóa 12 Cánh diều
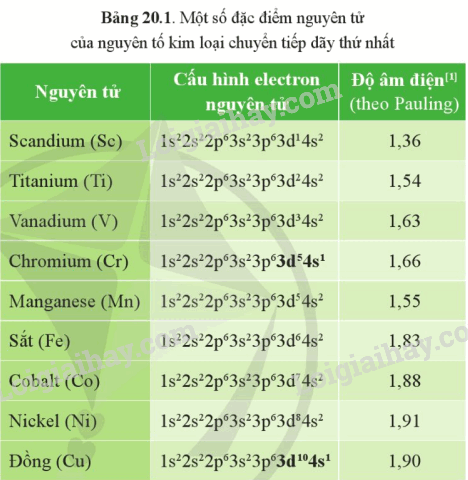
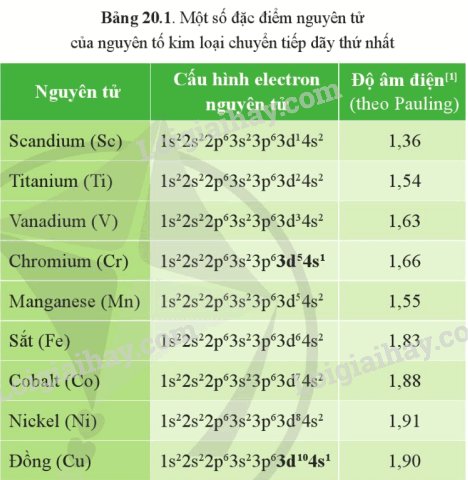
Dựa vào Bảng 20.1, giải thích vì sao nhiều kim loại chuyển tiếp dãy thứ nhất thường có số oxi hóa +2 trong các hợp chất.
Phương pháp giải:
Dựa vào bảng 20.1
Lời giải chi tiết:
Cấu hình electron nguyên tử của các nguyên tố trong dãy từ Sc đến Cu có xu hướng xếp đầy electron ở phân lớp 4s và tăng dần số electron ở phân lớp 3d. Do nhiều kim loại chuyển tiếp có 2 electron phân lớp 4s nên thường có số oxi hóa +2 trong các hợp chất.
CH tr 137
Trả lời câu hỏi trang 137 SGK Hóa 12 Cánh diều
Xác định số oxi hóa của sắt trong các hợp chất sau: FeO, Fe 2 O 3 , Fe 3 O 4 (hay FeO.Fe 2 O 3 )
Phương pháp giải:
Dựa vào quy tắc xác định số oxi hóa.
Lời giải chi tiết:
Số oxi hóa của O trong hầu hết hợp chất là – 2
Số oxi hóa của Fe trong FeO là +2
Số oxi hóa của Fe trong Fe 2 O 3 là +3
Số oxi hóa của Fe trong Fe 3 O 4 là +8/3
CH tr 138 TH1
Trả lời câu hỏi Thực hành 1 trang 138 SGK Hóa 12 Cánh diều
Thí nghiệm: Xác định nồng độ của dung dịch FeSO 4 bằng dung dịch KMnO 4 (dung dịch thuốc tím)
Chuẩn bị:
- Hóa chất: Dung dịch thuốc tím KMnO 4 có nồng độ chính xác 0,02M, dung dịch FeSO 4 có nồng độ khoảng 0,1M; dung dịch H 2 SO 4 20%
- Dụng cụ: Burette loại 25ml, bình tam giác loại 100ml
Tiến hành:
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0 đồng thời bảo đảm không còn bọt khí trong burette. Cho 10ml dung dịch FeSO 4 và 5ml dung dịch H 2 SO 4 20% vào bình tam giác.
- Mở khóa để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khóa burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng. Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO 4 . Biết phương trình hóa học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe 2+ (aq) + MnO 4 - (aq) + 8H + (aq) \( \to \)5Fe 3+ (aq) + Mn 2+ (aq) + 4H 2 O(l)
Phương pháp giải:
Dựa vào công thức chuẩn độ: C 1 .V 1 = C 2 .V 2
Lời giải chi tiết:
Gọi thể tích dung dịch KMnO4 đã dùng trong 2 lần là: V 1 và V 2
\( \to {\bar V_{KMnO4}} = \frac{{{V_1} + {V_2}}}{2}\)
theo phương trình chuẩn độ ta có:
\(\begin{array}{l}{C_{F{e^{2 + }}}}.{V_{F{e^{2 + }}}} = 5.{C_{KMn{O_4}}}.{{\bar V}_{KMn{O_4}}}\\ \to {C_{F{e^{2 + }}}} = \frac{{5.{C_{KMn{O_4}}}.{{\bar V}_{KMn{O_4}}}}}{{{V_{F{e^{2 + }}}}}}\end{array}\)
Lưu ý: thay số liệu thể tích KMnO 4 sau thí nghiệm vào công thức để xác định nồng độ FeSO 4 .
CH tr 138 TH2
Trả lời câu hỏi Thực hành 2 trang 138 SGK Hóa 12 Cánh diều
Thí nghiệm 2: Kiểm tra sự có mặt của cation Cu 2+ hoặc Fe 3+ trong dung dịch
Chuẩn bị:
- Hóa chất: Các dung dịch CuSO 4 0,1M; FeCl 3 0,1M; NaOH 0,1M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành:
- Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1ml dung dịch CuSO 4
- Cho khoảng 4 – 6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1ml dung dịch FeCl 3
Yêu cầu: Quan sát, giải thích hiện tượng và viết phương trình hóa học minh họa.
Phương pháp giải:
Dựa vào màu sắc kết tủa hydroxide của ion Cu 2+ và Fe 3+
Lời giải chi tiết:
Hiện tượng: ống nghiệm 1 có xuất hiện kết tủa trắng; ống nghiệm 2 có xuất hiện kết tủa nâu đỏ
PTHH: CuSO 4 + 2NaOH \( \to \)Na 2 SO 4 + Cu(OH) 2 \( \downarrow \)
FeCl 3 + 3NaOH \( \to \)3NaCl + Fe(OH) 3 \( \downarrow \)
CH tr 140
Trả lời câu hỏi Luyện tập trang 140 SGK Hóa 12 Cánh diều
Có nên sử dụng các kim loại chuyển tiếp dãy thứ nhất làm dây chảy trong các cầu chì không? Giải thích.
Phương pháp giải:
Dựa vào khả năng dẫn điện của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Không nên dùng. Vì cường độ chịu dòng điện của kim loại chuyển tiếp dãy thứ nhất lớn, khi dùng làm dây chảy không có khả năng tự ngắt điện gây cháy nổ.
CH tr 141 BT1
Trả lời câu hỏi Bài tập 1 trang 141 SGK Hóa 12 Cánh diều
a) Từ Bảng 20.1, hãy chỉ ra xu hướng biến đổi về số electron hóa trị của các nguyên tử nguyên tố từ scandium đến cobalt.
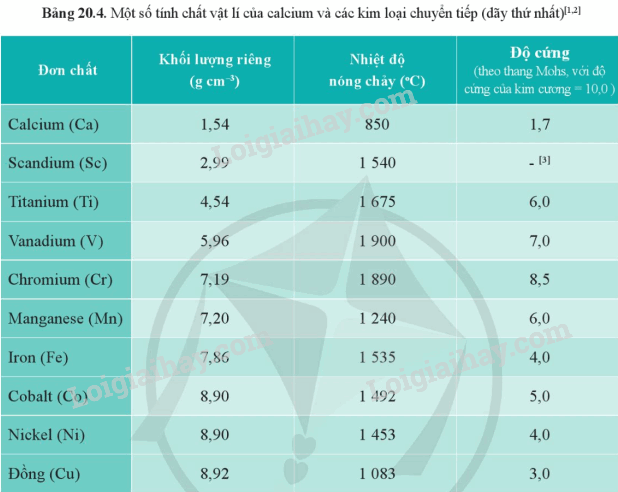
b) Từ Bảng 20.4, hãy chỉ ra xu hướng biến đổi về khối lượng riêng của các kim loại từ scandium đến đồng.
Phương pháp giải:
Dựa vào Bảng 20.1 và 20.4
Lời giải chi tiết:
a) Cấu hình electron nguyên tử của các nguyên tố trong dãy từ Sc đến Co có xu hướng đầy electron ở phân lớp 4s và tăng dần ở phân lớp 3d. Electron hóa trị của các nguyên tử từ Sc đến Co chủ yếu là 2 electron trừ Cr và Cu là ngoại lệ.
b) Khối lượng riêng của kim loại từ Sc đến Cu tăng dần.
CH tr 141 BT2
Trả lời câu hỏi Bài tập 2 trang 141 SGK Hóa 12 Cánh diều
Potassium là nguyên tố họ s, thuộc cùng chu kì 4 với các nguyên tố chuyển tiếp dãy thứ nhất.
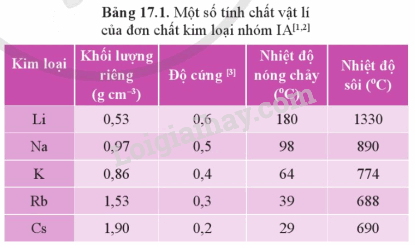
Từ Bảng 17.1 và Bảng 20.4, hãy chỉ ra sự khác biệt về khối lượng riêng, độ cứng và nhiệt độ nóng chảy giữa các kim loại chuyển tiếp dãy thứ nhất với kim loại potassium.
Phương pháp giải:
Dựa vào Bảng 17.1 và Bảng 20.4
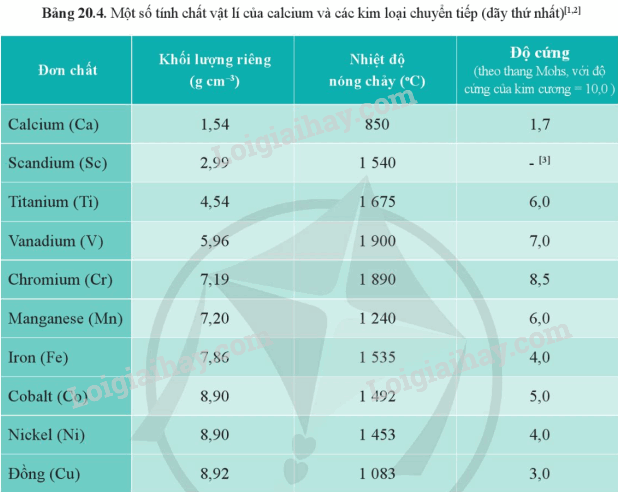
Lời giải chi tiết:
Khối lượng riêng của K là 0,86 g/cm 3 ; độ cứng: 0,4; nhiệt độ nóng chảy: 64
Trong khi đó khối lượng riêng, độ cứng và nhiệt độ nóng chảy từ Sc đến Cu lớn gấp nhiều lần so với K.
CH tr 141 BT3
Trả lời câu hỏi Bài tập 3 trang 141 SGK Hóa 12 Cánh diều
Một mẫu chất có thành phần chính là muối Mohr. Muối Mohr có công thức hóa học là (NH 4 ) 2 SO 4 .FeSO 4 .6H 2 O. Hòa tan 0,2151g mẫu chất trong dung dịch sulfuric acid loãng dư, thu được dung dịch có chứa cation Fe 2+ . Lượng Fe 2+ trong dung dịch này phản ứng vừa đủ với 5,40 ml dung dịch thuốc tím nồng độ 0,02M (Các chất và ion khác trong dung dịch không phản ứng với thuốc tím). Xác định
a) Số mg sắt có trong mẫu chất
b) Phần trăm khối lượng của (NH 4 ) 2 SO 4 .FeSO 4 .6H 2 O trong mẫu chất.
Phương pháp giải:
5Fe 2+ (aq) + MnO 4 - (aq) + 8H + (aq) \( \to \)5Fe 3+ (aq) + Mn 2+ (aq) + 4H 2 O(l)
Lời giải chi tiết:
n KMnO4 = 0,02 . 5,4 . 10 -3 =0,108.10 -3 mol
Phương trình chuẩn độ Fe 2+ bằng dung dịch thuốc tím là:
5Fe 2+ (aq) + MnO 4 - (aq) + 8H + (aq) \( \to \)5Fe 3+ (aq) + Mn 2+ (aq) + 4H 2 O(l)
0,54.10 -3 \( \leftarrow \)0,108.10 -3
a) Khối lượng sắt có trong mẫu chất là: 0,54.10 -3 .56 = 30,24.10 -3 g = 30,24mg
b) n Fe2+ = n (NH4)2SO4.FeSO4.6H2O = 0,54.10 -3 mol
%m (NH4)2SO4.FeSO4.6H2O = \(\frac{{0,{{54.10}^{ - 3}}.392}}{{0,2151}}.100 = 98,4\% \)