Bài 23. Alkane Vở thực hành Khoa học tự nhiên 9
Quan sát Hình 23.1 (trang 107, SGK KHTN 9) và thực hiện các yêu cầu sau:
23.1 1
Quan sát Hình 23.1 (trang 107, SGK KHTN 9) và thực hiện các yêu cầu sau:
1. Nhận xét đặc điểm chung về thành phần nguyên tố của ba chất trên.
Phương pháp giải:
Dựa vào hình 23.1
Lời giải chi tiết:
1. Đặc điểm chung về thành phần nguyên tố gồm C và H
23.1 2
2. So sánh đặc điểm cấu tạo (loại liên kết cộng hóa trị) giữa các nguyên tử trong phân tử của ba chất trên
Phương pháp giải:
Dựa vào hình 23.1
Lời giải chi tiết:
2. Liên kết giữa các nguyên tử trong phân tử của ba chất trên là liên kết cộng hóa trị.
23.2 1
Quan sát Hình 23.1 và cho biết hợp chất nào không thuộc alkane. Giải thích
Phương pháp giải:
Dựa vào khái niệm của alkane
Lời giải chi tiết:
Hợp chất methane và propane thuộc dãy alkane. Hợp chất ethylene không thuộc alkane. Vì ethylene có liên kết đôi trong phân tử trong đó alkane chỉ chứa liên kết đơn.
23.2 2
Xét các chất:
(A) CH
3
– CH
3
(B) CH
2
=CH-CH
3
(C)
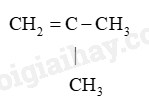
(D) CH
3
– CH
2
– OH (E) CH
3
– COOH (G)
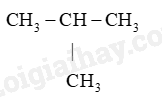
(H) CH 2 = CH – CH = CH 2 (I) CH 4
Trong các chất trên, chất nào là hydrocarbon, chất nào là alkane? Giải thích
Phương pháp giải:
Dựa vào khái niệm của alkane và hydrocarbon
Lời giải chi tiết:
Alkane: (A), (I), (G). Vì alkane là những hợp chất hydrocarbon mạch hở, chỉ chứa liên kết đôi
Hydrocarbon: (A), (B), (C), (G), (H), (I). Vì được cấu tạo từ C và H
23.3 1
Đọc thông tin trong bảng 23.1 (trang 108, SGK KHTN 9) và thực hiện các yêu cầu sau:
1. Trong công thức phân tử của alkane, khi tăng thêm một nguyên tử carbon thì số nguyên tử hydrocarbon tăng thêm là bao nhiêu?
Phương pháp giải:
Dựa vào bảng 23.1
Lời giải chi tiết:
1. Khi tăng 1 nguyên tử carbon thì số nguyên tử H tăng thêm 2
23.3 2
2. Hãy cho biết tên gọi của các alkane trong Bảng 23.1 có đặc điểm gì giống nhau và khác nhau.
Phương pháp giải:
Dựa vào bảng 23.1
Lời giải chi tiết:
2. Tên gọi của các alkane đều có đuôi “ane” , khác nhau tiền tố.
23.4 1
Tiến hành thí nghiệm: Tìm hiểu về phản ứng cháy của butane (trang 109, SGK KHTN 9) và thực hiện các yêu cầu sau:
1. Nhận xét hiện tượng bên trong thành bình tam giác sau khi đánh lửa bật gas để đốt cháy butane. Dự đoán sản phẩm tạo thành.
Phương pháp giải:
Dựa vào thí nghiệm; tìm hiểu về phản ứng cháy của butane
Lời giải chi tiết:
1. Trong bình xuất hiện khói trắng. Sản phẩm trong bình có thể có CO 2 và H 2 O.
23.4 2
2. Quan sát hiện tượng xảy ra trong bình tam giác sau khi cho nước vôi trong vào bình và dự đoán sản phẩm tạo thành.
Phương pháp giải:
Dựa vào thí nghiệm; tìm hiểu về phản ứng cháy của butane
Lời giải chi tiết:
2. Sau khi cho nước vôi trong vào bình sẽ xuất hiện vẩn đục trắng.
23.5
a) Viết phương trình hóa học biểu diễn phản ứng cháy của methane và ethane.
b) Dùng công thức chung của alkane, viết phương trình hóa học tổng quát của phản ứng đốt cháy hoàn toàn alkane tạo sản phẩm là carbon dioxide và nước.
Phương pháp giải:
Dựa vào tính chất của alkane
Lời giải chi tiết:
a) PTHH:
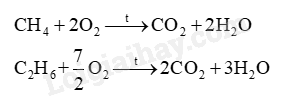
b) PTHH:
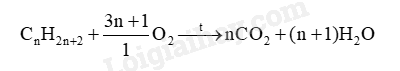
23.6
Giả thiết rằng gas trong bình gas là một hỗn hợp propane và butane có tỉ lệ thể tích 1:1. Tính nhiệt lượng sinh ra khi đốt cháy 1 kg loại gas này. Biết rằng nhiệt lượng tương ứng sinh ra khi đốt cháy 1 mol mỗi chất propane và butane lần lượt là 2220 kJ và 2878 kJ.
Phương pháp giải:
Dựa vào nhiệt lượng khi đốt cháy 1 mol mỗi chất
Lời giải chi tiết:
Gọi số mol của propane và butane là a mol
Khối lượng 1 kg gas là: m C3H8 + m C4H10 = 44a + 58a = 1.10 3 => a = 9,8 mol
Nhiệt lượng tương ứng khi đốt cháy 1 kg loại gas này: 9,8 . 2220 + 9,8 . 2878 = 49960,4 kJ
23.7
Đọc thông tin trong Bảng 23.2 (trang 110, SGK KHTN 9) và trình bày các ứng dụng chủ yếu của alkane.
Phương pháp giải:
Dựa vào bảng 23.3
Lời giải chi tiết:
Ứng dụng chủ yếu của alkane là: nhiên liệu.
23.8
Bảng dưới đây cho biết nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 mol alkane
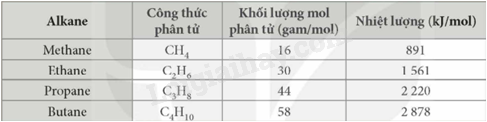
a) Tính nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 gam mỗi alkane trong bảng trên
b) Đốt cháy 1 gam alkane nào trong số các alkane ở trên sẽ tỏa ra nhiều lượng nhất?
Phương pháp giải:
Dựa vào bảng thông tin nhiệt lượng tỏa ra của các alkane
Lời giải chi tiết:
a) n CH4 = \(\frac{1}{{16}}\)=> Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1g CH 4 là: \(\frac{1}{{16}}\). 891 = 55,69 kJ
Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1g C 2 H 6 là: \(\frac{1}{{30}}.1561 = 52,033kJ\)
Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1g C 3 H 8 là: \(\frac{1}{{44}}.2220 = 50,45kJ\)
Nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1g C 4 H 10 là: \(\frac{1}{{58}}.2878 = 49,62kJ\)
b) Khi đốt cháy 1g CH 4 tỏa ra nhiều nhiệt nhất.
23.9
a) Viết công thức phân tử và công thức cấu tạo (dạng thu gọn) một alkane X, mạch không nhánh, phân tử có chứa 5 nguyên tử carbon.
b) Viết phương trình hóa học phản ứng đốt cháy alkane này.
Phương pháp giải:
Dựa vào công thức cấu tạo của alkane.
Lời giải chi tiết:
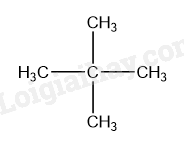
a) Công thức phân tử của alkane X có 5 nguyên tử carbon là: C 5 H 12 .
Công thức cấu tạo dạng thu gọn của C 5 H 12 :
CH 3 – CH 2 – CH 2 – CH 2 – CH 3
CH 3 – CH(CH 3 ) – CH 2 – CH 3
b) PTHH: C 5 H 12 + 8O 2 → 5CO 2 + 6H 2 O
23.10
Dựa trên tính chất hóa học của alkane, hãy giải thích tại sao một số alkane ở trạng thái lỏng lại có thể được sử dụng làm nhiên liệu trong động cơ đốt trong. Từ đó, hãy lập luận về vai trò của alkane trong việc ảnh hưởng đến môi trường khi chúng được sử dụng làm nhiên liệu.
Phương pháp giải:
Dựa vào ứng dụng của alkane.
Lời giải chi tiết:
Alkane là các hydrocarbon bão hòa với công thức tổng quát CₙH₂ₙ₊₂, có liên kết đơn giữa các nguyên tử carbon. Một số tính chất hóa học quan trọng của alkane giúp chúng phù hợp làm nhiên liệu trong động cơ đốt trong bao gồm:
Tính dễ cháy : Alkane dễ cháy và sinh ra nhiệt lượng lớn khi bị đốt cháy trong không khí. Phản ứng cháy hoàn toàn của alkane tạo ra carbon dioxide (CO₂) và nước (H₂O), kèm theo đó là sự tỏa nhiệt:
Vai trò của alkane trong việc ảnh hưởng đến môi trường
Khi được sử dụng làm nhiên liệu, alkane có thể gây ra những tác động tiêu cực đến môi trường, bao gồm:
Phát thải CO₂ : Đốt cháy alkane tạo ra CO₂, một khí nhà kính chính gây ra hiện tượng nóng lên toàn cầu. Việc sử dụng alkane làm nhiên liệu trong động cơ đốt trong góp phần làm tăng nồng độ CO₂ trong khí quyển, thúc đẩy biến đổi khí hậu.
Ô nhiễm không khí : Ngoài CO₂, phản ứng đốt cháy không hoàn toàn của alkane có thể tạo ra carbon monoxide (CO), oxit nitơ (NOₓ), và các hạt bụi mịn. Những chất này góp phần vào ô nhiễm không khí, ảnh hưởng đến sức khỏe con người và hệ sinh thái.
Khai thác và xử lý dầu mỏ : Alkane chủ yếu được chiết xuất từ dầu mỏ, việc khai thác và xử lý dầu mỏ có thể gây ra ô nhiễm môi trường như tràn dầu, ô nhiễm đất và nước.
Như vậy, mặc dù alkane có những tính chất giúp chúng trở thành nhiên liệu hiệu quả trong động cơ đốt trong, việc sử dụng chúng đi kèm với những tác động tiêu cực đến môi trường. Điều này nhấn mạnh sự cần thiết của việc tìm kiếm các nguồn năng lượng sạch và bền vững hơn để giảm thiểu ảnh hưởng xấu đến môi trường.