Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 5
Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là ? Xét ba nguyên tố X ( Z = 2); Y ( Z = 16), T ( Z =19). Phát biểu nào sau đây đúng
Đề bài
I. Trắc nghiệm (5 điểm)
Câu 1: Chọn phát biểu sai
A. Lớp K là lớp gần hạt nhân nhất và có năng lượng thấp nhất
B. Phân lớp 4s có năng lượng cao hơn phân lớp 3d
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 phân lớp
Câu 2: Cho các phát biểu sau
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và neutron.
(2). Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3). Trong nguyên tử số electron bằng số proton.
(4). Trong hạt nhân, nguyên tử hạt mang điện là proton và electron.
(5). Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1 B. 2 C. 3 D. 4
Câu 3: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là ( 11 Na; 13 Al; 15 P; 17 Cl; Fe)
A. Fe và Cl. B. Na và Cl. C. Al và Cl. D. Al và P.
Câu 4: Xét ba nguyên tố X ( Z = 2); Y ( Z = 16), T ( Z =19). Phát biểu nào sau đây đúng
A. X là khí hiếm, Y là phi kim, T là kim loại.
B. X và T là kim loại, Y là phi kim.
C. X, Y là khí hiếm, T là kim loại.
D. Tất cả đều sai.
Câu 5: Cấu hình electron của nguyên tử nguyên tố X có dạng (Ne)3s 2 3p 3 . Phát biểu nào sau đây là sai?
A. Lớp ngoài cùng của X có 5 electron.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Câu 6: Trong tự nhiên, nguyên tố boron có 2 đồng vị: 11 B và 10 B. Biết nguyên tử khối trung bình của boron là 10,812 và xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối. Nếu có 406 nguyên tử 11 B thì số nguyên tử 10 B là
A. 94. B. 100. C. 50. D. 406.
Câu 7: Nguyên tố hoá học là
A. những nguyên tử có cùng số neutron.
B. những nguyên tử có cùng điện tích hạt nhân.
C. những phân tử có cùng phân tử khối.
D. những nguyên tử có cùng số khối.
Câu 8: Nguyên tử nguyên tố X có tổng electron s là 5. Số hiệu nguyên tử của X là
A. 12 B.7 C. 11 D. 5
Câu 9: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của
nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là:
A. phi kim và kim loại.
B. kim loại và kim loại.
C. khí hiếm và kim loại.
D. kim loại và khí hiếm.
Câu 10: Cho các cấu hình electron của các nguyên tố sau
(1) 1s 2 2s 2 2p 6 3s 2
(2) 1s 2 2s 2 2p 6 3s 2 3p 5
(3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
(4) 1s 2 2s 2 2p 6
Nguyên tố kim loại là
A. (1), (3). B. (1), (2), (4).
C. (2), (4). D. (2), (3), (4).
II. Tự luận (5 điểm)
Câu 1 (3 điểm) Trong tự nhiên, Chlorine có 2 đồng vị là 35 Cl và 37 Cl. Nguyên tử khối trung bình của Chlorine bằng 35,5.
a) Tính tỉ lệ phần trăm số nguyên tử của từng đồng vị.
b) Có bao nhiêu nguyên tử 35 Cl trong 2,24 lít khí Cl 2 (đktc)?
c) Tính thành phần phần trăm khối lượng của đồng vị 37 Cl có trong 31,2 gam BaCl 2 (Cho Ba = 137).
d) Trong tự nhiên Hydrogen có 2 đồng vị 1 H, 2 H. Hỏi có tối đa bao nhiêu loại phân tử HCl? Tính
phân tử khối của từng loại.
Câu 2 (2 điểm) Tổng số hạt proton, electron, neutron trong nguyên tử nguyên tố X là 48, trong đó số hạt mang điện gấp đôi số hạt không mang điện.
a) Tính số hạt mỗi loại, số hiệu nguyên tử, số khối của X. X là nguyên tố nào.
b) Viết cấu hình electron của X. X là kim loại? Phi kim? Khí hiếm?
c) Biểu diễn lớp ngoài cùng theo ô orbital và xác định số electron độc thân của X
-------- Hết --------
Đáp án
I. Phần trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
B |
C |
A |
D |
A |
B |
C |
A |
A |
Lời giải chi tiết
Câu 1:
A đúng
B sai vì thứ tự các mức năng lượng các phân lớp từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
-> Phân lớp 4s có năng lượng thấp hơn phân lớp 3d
C đúng
D đúng, các phân lớp đó là: 4s, 4p, 4d, 4f
-> Đáp án B
Câu 2:
(1) sai vì nguyên tử hydrogen không có hạt neutron
(2) sai vì khối lượng electron không đáng kể -> khối lượng nguyên tử tập trng ở hạt nhân
(3) đúng
(4) sai vì trong hạt nhân, hạt mang điện chỉ có proton
(5) đúng
-> Đáp án B
Câu 3:
Phương pháp giải:
Viết cấu hình electron của X
-> Số electron của X -> số electron của Y
Lời giải chi tiết:
X có tổng số hạt electron trong các phân lớp p là 7
-> Cấu hình electron của X có dạng: 1s 2 2s 2 2p 6 3s 2 3p 1
-> X có 13 electron -> X là Al
-> Số hạt mang điện của X = 2.13 = 26
Số hạt mang điện của một ngyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt
-> Số E và P (của Y) = 26 + 8 = 34 hạt
-> Số e = 34:2 = 17
-> Y là Cl
-> đáp án C
Câu 4:
Phương pháp giải:
Viết vấu hình electron của cả 3 nguyên tố X, Y, T
Nguyên tử có 1, 2, 3 eletron lớp ngoài cùng là nguyên tố kim loại
Nguyên tử có 5, 6, 7 eletron lớp ngoài cùng là nguyên tố phi kim
Nguyên tử có 8 eletron lớp ngoài cùng là nguyên tố khí hiếm
Lời giải chi tiết
X (Z=2): 1s 2
-> X có 2 electron, TH đặc biệt của He -> khí hiếm
Y (Z=16): 1s 2 2s 2 2p 6 3s 2 3p 4
-> Y có 6 electron lớp ngoài cùng -> phi kim
T (Z=19): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
-> T có 1 electron lớp ngoài cùng -> Kim loại
-> Đáp án A
Câu 5:
A đúng
B đúng vì có 5 electron lớp ngoài cùng
C đúng vì cấu hình e cụ thể là: 1s 2 2s 2 2p 6 3s 2 3p 3
D. sai vì nguyên tố X có 5 phân lớp và có 3 lớp
-> Đáp án D
Câu 6:
Phương pháp giải:
Xác định số % nguyên tử của mỗi đồng vị
Áp dụng CT tính nguyên tử khối trung bình
\(\overline {{A_X}} = \frac{{{a_1}{A_1} + {a_2}{A_2} + ... + {a_i}{A_i}}}{{100}}\)
\(\overline {{A_X}} \)là nguyên tử khối trung bình của X
A i là nguyên tử khối đồng vị thứ i
a i là tỉ lệ % số nguyên tử đồng vị thứ i
Lời giải chi tiết:
Gọi % số nguyên tử của đồng vị 11 B là x
-> % số nguyên tử của đồng vị 10 B là 100 – x
Áp dụng CT tính nguyên tử khối trung bình
-> \(\overline {{A_B}} = \frac{{x.11 + (100 - x).10}}{{100}} = 10,812\)
-> x = 81,2%
% số nguyên tử của đồng vị 11 B là 81,2%
% số nguyên tử của đồng vị 10 B là 18,8%
Ta có: tổng số nguyên tử của cả 2 đồng vị = \(\frac{{406.100}}{{81,2}} = 500\)(nguyên tử)
-> Số nguyên tử đồng vị 10 B là: 500 – 406 = 94 (nguyên tử)
-> Đáp án A
Câu 7:
Phương pháp giải:
Định nghĩa nguyên tố hóa học:
Là những nguyên tố có cùng số proton hoặc số điện tích hạt nhân
Lời giải chi tiết:
Đáp án B
Câu 8:
X có tổng electron s là 5
-> Cấu hình e: 1s 2 2s 2 2p 6 3s 1
-> E = P = Z = 11
-> Đáp án C
Câu 9:
Phương pháp giải:
- Xác định cấu hình electron của Y -> số e của Y
-> Số e của X
Nguyên tử có 1, 2, 3 eletron lớp ngoài cùng là nguyên tố kim loại
Nguyên tử có 5, 6, 7 eletron lớp ngoài cùng là nguyên tố phi kim
Nguyên tử có 8 eletron lớp ngoài cùng là nguyên tố khí hiếm
Lời giải chi tiết:
Nguyên tố Y có mức năng lượng cao nhất là 3p. và có 1 electron ở lớp ngoài cùng
-> Cấu hình electron của Y là: 1s 2 2s 2 2p 6 3s 2 3p 1 (13 electron)
- Y có 3 electron lớp ngoài cùng -> kim loại
Nguyên tử X và Y có số electron hơn kém nhau là 2
TH1: X kém Y 2 electron
-> X có 13 – 2 = 11 electron
-> Cấu hình e của X: : 1s 2 2s 2 2p 6 3s 1
Mà đề bài cho X có mức năng lượng cao nhất là 3p
-> TH1 loại
TH2: X hơn Y 2 electron
-> X có 13 + 2 = 15 electron
-> Cấu hình e của X: : 1s 2 2s 2 2p 6 3s 2 3p 3
-> X có 5 electron lớp ngoài cùng -> X là phi kim
-> Đáp án A
Câu 10
Phương pháp giải:
Nguyên tử có 1, 2, 3 eletron lớp ngoài cùng là nguyên tố kim loại
Nguyên tử có 5, 6, 7 eletron lớp ngoài cùng là nguyên tố phi kim
Nguyên tử có 8 eletron lớp ngoài cùng là nguyên tố khí hiếm
Lời giải chi tiết
(1) có 2 electron lớp ngoài cùng -> kim loại
(2) có 7 electron lớp ngoài cùng -> phi kim
(3) có 2 electron lớp ngoài cùng -> kim loại
(4) có 8 electron lớp ngoài cùng -> khí hiếm
-> đáp án A
II. Tự luận:
Câu 1:
a) Gọi % số nguyên tử của đồng vị 35 Cl là x
-> % số nguyên tử của đồng vị 37 Cl là 100 – x
Áp dụng CT tính nguyên tử khối trung bình
-> \(\overline {{A_B}} = \frac{{x.35 + (100 - x).37}}{{100}} = 35,5\)
-> x = 75%
% số nguyên tử của đồng vị 35 Cl 75%
% số nguyên tử của đồng vị 37 Cl là 25%
b) \({n_{C{l_2}}} = \frac{{2,24}}{{22,4}} = 0,1\)mol
Số nguyên tử Cl (trong Cl 2 ) = 0,1.2.6,02.10 23 = 12,04.10 22 (nguyên tử)
-> Số nguyên tử 35 Cl = 12,04.10 22 . 75% = 9,03.10 22 (nguyên tử)
c) \({n_{BaC{l_2}}} = \frac{{31,2}}{{208}} = 0,15\)(mol)
-> Số nguyên tử Cl trong BaCl 2 = 0,15.2. 6,02.10 23 = 1,806.10 23 (nguyên tử)
-> Số nguyên tử 37 Cl = 1,806.10 23 . 25% = 4,515.10 22 (nguyên tử)
d) Có thể tạo ra tối đa 4 loại phân tử HCl
(1) \({}^1H{}^{35}Cl\) M = 36
(2) \({}^1H{}^{37}Cl\) M = 38
(3) \({}^2H{}^{35}Cl\) M = 37
(4) \({}^2H{}^{37}Cl\) M = 39
Câu 2:
Gọi P, N, E lần lượt là số proton, neutron và electron của X cần tìm
Tổng số hạt proton, electron, neutron trong nguyên tử nguyên tố X là 48
→ P + E + N = 48 (1)
Số hạt mang điện gấp đôi số hạt không mang điện
→ P + N = 2N (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 16 và N = 16
Số hiệu nguyên tử Z = P = E = 16
Số khối A = P + N = 16 + 16 = 32
-> X là sulfur (S)
b) Cấu hình e của X : 1s 2 2s 2 2p 6 3s 2 3p 4
X có 6 electron lớp ngoài cùng -> X là phi kim
c) Lớp ngoài cùng: n = 3
Biểu diễn theo ô orbital:
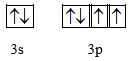
-> X có 2 electron độc thân