Đề thi giữa kì 1 Hóa 11 Cánh diều - Đề số 1
Phát biểu nào sau đây đúng ? A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận C. Nếu tăng lượng xúc tác V2O5 thì cân bằng dịch chuyển theo chiều thuận D. Nếu giảm nồng độ của SO3 thì cân bằng dịch chuyển theo chiều thuận
Đề thi
I. Trắc nghiệm (6 điểm)
Câu 1: Cho cân bằng hóa học sau:
\(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\) \({\Delta _r}H_{298}^o < 0\)
Phát biểu nào sau đây đúng ?
A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch
B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận
C. Nếu tăng lượng xúc tác V 2 O 5 thì cân bằng dịch chuyển theo chiều thuận
D. Nếu giảm nồng độ của SO 3 thì cân bằng dịch chuyển theo chiều thuận
Câu 2: Cho phản ứng hóa học sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\). Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}\)
B. \({K_C} = \sqrt {\frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}} \)
C. \(\frac{{2[S{O_3}]}}{{2[S{O_2}]{\rm{[}}{O_2}]}}\) D. \({K_C} = \frac{{{\rm{[}}S{O_3}]}}{{{\rm{[}}S{O_2}]{\rm{[}}{O_2}]}}\)
Câu 3: Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ?
A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Câu 4: Cho các phản ứng hóa học sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\) (2) \(2N{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {N_2}{O_4}(g)\)
(3) \(PC{l_5}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} PC{l_3}(g) + C{l_2}(g)\) (4) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Khi thay đổi áp suất, số cân bằng hóa học bị dịch chuyển là ?
A. (1), (2), (3), (4) B. (2), (3), (4) C. (1), (2) D. (1), (2), (4)
Câu 5: Ở 600 o K, đối với phản ứng: \({H_2}(g) + C{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}O(g)\)
Nồng độ cân bằng của H 2 , CO 2 , H 2 O và CO lần lượt là 0,6M; 0,459M; 0,5M và 0,425M. Tìm K C của phản ứng ?
A. 0,772 B. 0,864 C. 0,562 D. 0,988
Câu 6: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH 4 + , NH 3 .
B. NH 4 + , NH 3 , H + .
C. NH 4 + , OH - .
D. NH 4 + , NH 3 , OH -
Câu 7: Hòa tan m gam Fe bằng dung dịch HNO 3 dư thu được 6,1975 lít hỗn hợp khí X gồm NO, N 2 O (đkc) (biết tỉ khối X so với H 2 bằng 19,2). Giá trị m là
A. 21. B. 6,4. C. 56. D. 28.
Câu 8: Chất nào sau đây thuộc loại chất điện ly mạnh ?
A. NaCl B. CH 3 COOH C. C 2 H 5 OH D. H 3 PO 4
Câu 9: Phương trình điện li nào sau đây không đúng ?
A. \(HCl \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + C{l^ - }\) B. \(C{H_3}COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CH3CO{O^ - } + {H^ + }\)
C. \({H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}P{O_4}^ - \) D. \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
Câu 10: Cho các dung dịch axit có cùng nồng độ mol: HNO 3 , HCl, H 2 SO 4 , H 3 PO 4 . Dung dịch có pH lớn nhất là
A. H 2 SO 4 B. HCl C. HNO 3 D. H 3 PO 4
Câu 11: Trong phản ứng sau đây, những chất nào đóng vai trò là acid theo thuyết Bronsted – lowry?
\({H_2}S(aq) + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - }(aq) + {H_3}{O^ + }\)
A. H 2 S và H 2 O B. H 2 S và H 3 O + C. H 2 S và HS - D. H 2 O và H 3 O +
Câu 12: Một loại dầu gội có nồng độ ion OH - là 10 5,17 mol/L
pH của loại dầu gội đầu nói trên là:
A. 8,0 B. 9,0 C. 8,83 D. 9,83
Câu 13: pH của dung dịch thu được sau khi trộn 40ml dung dịch HCl 0,5M với 60ml dung dịch NaOH 0,5M:
A. 7 B. 1 C. 13 D. 14
Câu 14: Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14 N (99,63%) và 15 N (0,37%). Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.
Câu 15: Cho 100 ml dung dịch NH 4 Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH 3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
II. Tự luận (4 điểm)
Câu 1: Methanol và propanoic acid phản ứng với nhau tạo thành methy propanoate theo phản ứng hóa học sau: \(C{H_3}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {C_2}{H_5}COOC{H_3}(l) + {H_2}O(l)\)
Ở 50 0 C, giá trị K C của phản ứng trên là 7,5. Nếu cho 11,5 g methanol phản ứng với 37,0 g propanoic acid ở 50 0 C thì khối lượng của methy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Câu 2: Hỗn hợp A gồm N 2 và H 2 theo tỷ lệ thể tích 1:3, tạo phản ứng giữa N 2 và H 2 sinh ra NH 3 . Sau phản ứng được hỗn hợp khí B có tỉ khối so với khí A là 10/6. Tính hiệu suất phản ứng trên?
Đáp án
Phần trắc nghiệm
|
1A |
2A |
3C |
4B |
5A |
6D |
7D |
8A |
|
9A |
10A |
11B |
12C |
13C |
14B |
15A |
Câu 1: Cho cân bằng hóa học sau:
\(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\) \({\Delta _r}H_{298}^o < 0\)
Phát biểu nào sau đây đúng ?
A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch
B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận
C. Nếu tăng lượng xúc tác V 2 O 5 thì cân bằng dịch chuyển theo chiều thuận
D. Nếu giảm nồng độ của SO 3 thì cân bằng dịch chuyển theo chiều thuận
Phương pháp giải
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học
Lời giải chi tiết
Vì \({\Delta _r}H_{298}^o < 0\) nên khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều nghịch
Đáp án A
Câu 2: Cho phản ứng hóa học sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\). Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}\) B. \({K_C} = \sqrt {\frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}} \)
C. \(\frac{{2[S{O_3}]}}{{2[S{O_2}]{\rm{[}}{O_2}]}}\)
D. \({K_C} = \frac{{{\rm{[}}S{O_3}]}}{{{\rm{[}}S{O_2}]{\rm{[}}{O_2}]}}\)
Phương pháp giải
Dựa vào biểu thức hằng số cân bằng hóa học
Lời giải chi tiết
Đáp án A\(\frac{{2[S{O_3}]}}{{2[S{O_2}]{\rm{[}}{O_2}]}}\)
Câu 3: Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ?
A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Phương pháp giải
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học
Lời giải chi tiết
Đáp án C
Câu 4: Cho các phản ứng hóa học sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\) (2) \(2N{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {N_2}{O_4}(g)\)
(3) \(PC{l_5}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} PC{l_3}(g) + C{l_2}(g)\) (4) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Khi thay đổi áp suất, số cân bằng hóa học bị thay đổi là ?
A. (1), (2), (3), (4) B. (2), (3), (4) C. (1), (2) D. (1), (2), (4)
Phương pháp giải
Khi thay đổi áp suất, cân bằng sẽ thay đổi nếu số mol khí của chất tham gia khác số mol khí của sản phẩm
Lời giải chi tiết
Đáp án B
Câu 5: Ở 600 o K, đối với phản ứng: \({H_2}(g) + C{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}O(g)\)
Nồng độ cân bằng của H 2 , CO 2 , H 2 O và CO lần lượt là 0,6M; 0,459M; 0,5M và 0,425M. Tìm K C của phản ứng ?
A. 0,772 B. 0,864 C. 0,562 D. 0,988
Phương pháp giải
Dựa vào biểu thức tính hằng số cân bằng hóa học KC
Lời giải
\({K_C} = \frac{{{\rm{[}}CO]{\rm{[}}{H_2}O]}}{{{\rm{[}}{H_2}]{\rm{[}}C{O_2}]}} = \frac{{0,5.0,425}}{{0,6.0,459}} = 0,772\)
Đáp án A
Câu 6: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH 4 + , NH 3 .
B. NH 4 + , NH 3 , H + .
C. NH 4 + , OH - .
D. NH 4 + , NH 3 , OH -
Phương pháp giải
Dựa vào sự điện li của ammoia trong nước
\(N{H_3} + {H_2}O \to N{H_4}^ + + O{H^ - }\)
Lời giải chi tiết
Đáp án D
Câu 7: Hòa tan m gam Fe bằng dung dịch HNO 3 dư thu được 6,1975 lít hỗn hợp khí X gồm NO, N 2 O (đkc) (biết tỉ khối X so với H 2 bằng 19,2). Giá trị m là
A. 21. B. 6,4. C. 56. D. 28.
Phương pháp
Dựa vào phương pháp bảo toàn electron
Lời giải chi tiết
\(\begin{array}{l}{n_{hh}} = \frac{{6,1975}}{{24,79}} = 0,25\\{d_{X/{H_2}}} = \frac{{{M_X}}}{2} = 19,2 \to {M_x} = 19,2.2 = 38,4\\{m_{hh}} = 38,4.0,25 = 9,6g\end{array}\)
Gọi n NO , n N2O lần lượt là x, y (mol)
\(\begin{array}{l}\left\{ \begin{array}{l}x + y = 0,25\\30x + 44y = 9,6g\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,15\end{array} \right.\\F{e^o} \to F{e^{ + 3}} + 3e\\{N^{ + 5}} + 3e \to {N^{ + 2}}\\2{N^{ + 5}} + 8e \to 2{N^{ + 1}}\\BTe:3{n_{Fe}} = 3{n_{NO}} + 8{n_{{N_2}O}}\\ \to {n_{Fe}} = \frac{{3.0,1 + 8.0,15}}{3} = 0,5\\{m_{Fe}} = 0,5.56 = 28g\end{array}\)
Đáp án D
Câu 8: Chất nào sau đây thuộc loại chất điện ly mạnh ?
A. NaCl B. CH 3 COOH C. C 2 H 5 OH D. H 3 PO 4
Phương pháp giải
Dựa vào phân loại chất điện ly mạnh: acid mạnh, dung dịch base, muối tan
Lời giải chi tiết
Đáp án A
Câu 9: Phương trình điện li nào sau đây không đúng ?
A. \(HCl \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + C{l^ - }\) B. \(C{H_3}COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CH3CO{O^ - } + {H^ + }\)
C. \({H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}P{O_4}^ - \) D. \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
Phương pháp giải
Phương trình điện li đối với chất điện li mạnh dùng mũi tên một chiều, chất điện li yếu dùng mũi tên 2 chiều
Lời giải chi tiết
Đáp án A, vì HCl là chất điện li mạnh
Câu 10: Cho các dung dịch acid có cùng nồng độ mol: HNO 3 , HCl, H 2 SO 4 , H 3 PO 4 . Dung dịch có pH lớn nhất là
A. H 2 SO 4 B. HCl C. HNO 3 D. H 3 PO 4
Phương pháp
Dựa vào nồng độ H + từ sự điện li của các acid
Lời giải chi tiết
Acid mạnh có nồng độ H + cao thì pH lớn
Đáp án A
Câu 11: Trong phản ứng sau đây, những chất nào đóng vai trò là acid theo thuyết Bronsted – lowry?
\({H_2}S(aq) + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - }(aq) + {H_3}{O^ + }\)
A. H 2 S và H 2 O B. H 2 S và H 3 O + C. H 2 S và HS - D. H 2 O và H 3 O +
Phương pháp giải
Dựa vào thuyết Bronsted – Lowry
Lời giải chi tiết
Trong phản ứng thuận, H 2 S đã nhường H + cho H 2 O nên đóng vai trò acid.
Trong phản ứng nghịch, H 3 O + đã nhường H + cho HS – nên đóng vai trò là acid
Đáp án B
Câu 12: Một loại dầu gội có nồng độ ion OH - là 10 - 5,17 mol/L
pH của loại dầu gội đầu nói trên là:
A. 8,0 B. 9,0 C. 8,83 D. 9,83
Phương pháp giải
Dựa vào công thức tính pH
Lời giải chi tiết
[OH - ]=10 - 5,17 mol/L \(\begin{array}{l} \to {\rm{[}}H + {\rm{]}} = \frac{{{{10}^{ - 14}}}}{{{{10}^{ - 5,17}}}} = {10^{ - 8,83}}M\\ \to pH = 8,83\end{array}\)
Đáp án C
Câu 13: pH của dung dịch thu được sau khi trộn 40ml dung dịch HCl 0,5M với 60ml dung dịch NaOH 0,5M:
A. 7 B. 1 C. 13 D. 14
Phương pháp giải
Dựa vào công thức pH
Lời giải chi tiết
\(\begin{array}{l}{n_{{H^ + }}} = 0,04.0,5 = 0,02mol\\{n_{O{H^ - }}} = 0,06.0,5 = 0,03mol\\ \to {n_{O{H^ - }}} > {n_{{H^ + }}}\end{array}\)
Nên NaOH dư, HCl hết \(\begin{array}{l} \to {n_{O{H^ - }_{d{\rm{u}}}}} = 0,01 \to {\rm{[}}O{H^ - }{\rm{]}} = \frac{{0,01}}{{0,1}} = 0,1M\\ \to pH = 13\end{array}\)
Đáp án C
Câu 14: Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14 N (99,63%) và 15 N (0,37%). Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.
Phương pháp:
Nguyên tử khối trung bình: \(\mathop A\limits^ - = \frac{{{A_1}.{x_1} + {A_2}.{x_2} + ... + {A_n}{x_n}}}{{100}}\)
Trong đó: + \(\mathop A\limits^ - \)là nguyên tử khối trung bình; A 1 , A 2 , ..., A n là nguyên tử khối của các đồng vị;
+ x 1 , x 2 , ..., x n là phần trăm số nguyên tử của các đồng vị đồng vị (x 1 + x 2 + ...+ x n = 100%).
Lời giải chi tiết: \({\mathop A\limits^ - _N} = \frac{{14.99,63 + 15.0,37}}{{100}} = 14,0037 \approx 14,004\)
→ Chọn B .
Câu 15: Cho 100 ml dung dịch NH 4 Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH 3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
Phương pháp giải
Dựa vào phản ứng của NH 4 Cl tác dụng với NaOH
Lời giải chi tiết
\(\begin{array}{l}{n_{N{H_4}Cl}} = 0,1.1 = 0,1mol\\N{H_4}Cl + NaOH \to N{H_3} + NaCl + {H_2}O\\0,1\end{array}\)
V NH3 = 0,1.24,79 = 2,479 lít
Đáp án A
II. Tự luận
Câu 1: Methanol và propanoic acid phản ứng với nhau tạo thành methy propanoate theo phản ứng hóa học sau: \(C{H_3}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{H_3}COO{C_2}{H_5}(l) + {H_2}O(l)\)
Ở 50 0 C, giá trị K C của phản ứng trên là 7,5. Nếu cho 8,0 g methanol phản ứng với 37,0 g propanoic acid ở 50 0 C thì khối lượng của methy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Lời giải chi tiết
\(\begin{array}{l}{n_{C{H_3}OH}} = \frac{8}{{32}} = 0,25mol\\{n_{C2H5COOH}} = \frac{{37}}{{74}} = 0,5mol\end{array}\)
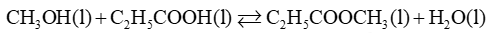
Trước phản ứng: 0,25 0,5 0 0
Phản ứng: x x x x
Sau phản ứng: 0,25 – x 0,5 – x x x
\(\begin{array}{l}{K_C} = \frac{{{\rm{[}}{C_2}{H_5}COOC{H_3}]{\rm{[}}{H_2}O]}}{{{\rm{[}}C{H_3}OH]{\rm{[}}{C_2}{H_5}COOH]}} = 7,5\\ \to \frac{{\frac{x}{V}.\frac{x}{V}}}{{\frac{{0,25 - x}}{V}.\frac{{0,5 - x}}{V}}} = 7,5\\\left[ \begin{array}{l}{x_1} = 0,225 \to {m_{C{H_3}COO{C_2}{H_5}}} = 0,225.88 = 19,8g\\{x_2} = 0,64(loai,x > 0,5)\end{array} \right.\end{array}\)
Câu 2: Hỗn hợp A gồm N 2 và H 2 theo tỷ lệ thể tích 1:3, tạo phản ứng giữa N 2 và H 2 sinh ra NH 3 . Sau phản ứng được hỗn hợp khí B có tỉ khối so với khí A là 10/6. Tính hiệu suất phản ứng trên?
Lời giải chi tiết
Vì tỉ lệ thể tích của N 2 và H 2 là 1:3. Giả sử mol N 2 là 1 mol, n H2 là 3 mol
