Tổng hợp 7 đề thi giữa kì 1 Hóa 11 Cánh diều có đáp án
Tải vềPhát biểu nào sau đây đúng ? A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận C. Nếu tăng lượng xúc tác V2O5 thì cân bằng dịch chuyển theo chiều thuận D. Nếu giảm nồng độ của SO3 thì cân bằng dịch chuyển theo chiều thuận
Đề 1
I. Trắc nghiệm (6 điểm)
Câu 1: Cho cân bằng hóa học sau:
\(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\) \({\Delta _r}H_{298}^o < 0\)
Phát biểu nào sau đây đúng ?
A. Nếu tăng áp suất của hệ thì cân bằng dịch chuyển theo chiều nghịch
B. Nếu tăng nhiệt độ của hệ thì cân bằng dịch chuyển theo chiều thuận
C. Nếu tăng lượng xúc tác V 2 O 5 thì cân bằng dịch chuyển theo chiều thuận
D. Nếu giảm nồng độ của SO 3 thì cân bằng dịch chuyển theo chiều thuận
Câu 2: Cho phản ứng hóa học sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\). Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}\)
B. \({K_C} = \sqrt {\frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}} \)
C. \(\frac{{2[S{O_3}]}}{{2[S{O_2}]{\rm{[}}{O_2}]}}\) D. \({K_C} = \frac{{{\rm{[}}S{O_3}]}}{{{\rm{[}}S{O_2}]{\rm{[}}{O_2}]}}\)
Câu 3: Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ?
A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Câu 4: Cho các phản ứng hóa học sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\) (2) \(2N{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {N_2}{O_4}(g)\)
(3) \(PC{l_5}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} PC{l_3}(g) + C{l_2}(g)\) (4) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Khi thay đổi áp suất, số cân bằng hóa học bị dịch chuyển là ?
A. (1), (2), (3), (4) B. (2), (3), (4) C. (1), (2) D. (1), (2), (4)
Câu 5: Ở 600 o K, đối với phản ứng: \({H_2}(g) + C{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}O(g)\)
Nồng độ cân bằng của H 2 , CO 2 , H 2 O và CO lần lượt là 0,6M; 0,459M; 0,5M và 0,425M. Tìm K C của phản ứng ?
A. 0,772 B. 0,864 C. 0,562 D. 0,988
Câu 6: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH 4 + , NH 3 .
B. NH 4 + , NH 3 , H + .
C. NH 4 + , OH - .
D. NH 4 + , NH 3 , OH -
Câu 7: Hòa tan m gam Fe bằng dung dịch HNO 3 dư thu được 6,1975 lít hỗn hợp khí X gồm NO, N 2 O (đkc) (biết tỉ khối X so với H 2 bằng 19,2). Giá trị m là
A. 21. B. 6,4. C. 56. D. 28.
Câu 8: Chất nào sau đây thuộc loại chất điện ly mạnh ?
A. NaCl B. CH 3 COOH C. C 2 H 5 OH D. H 3 PO 4
Câu 9: Phương trình điện li nào sau đây không đúng ?
A. \(HCl \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + C{l^ - }\) B. \(C{H_3}COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CH3CO{O^ - } + {H^ + }\)
C. \({H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}P{O_4}^ - \) D. \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
Câu 10: Cho các dung dịch axit có cùng nồng độ mol: HNO 3 , HCl, H 2 SO 4 , H 3 PO 4 . Dung dịch có pH lớn nhất là
A. H 2 SO 4 B. HCl C. HNO 3 D. H 3 PO 4
Câu 11: Trong phản ứng sau đây, những chất nào đóng vai trò là acid theo thuyết Bronsted – lowry?
\({H_2}S(aq) + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H{S^ - }(aq) + {H_3}{O^ + }\)
A. H 2 S và H 2 O B. H 2 S và H 3 O + C. H 2 S và HS - D. H 2 O và H 3 O +
Câu 12: Một loại dầu gội có nồng độ ion OH - là 10 5,17 mol/L
pH của loại dầu gội đầu nói trên là:
A. 8,0 B. 9,0 C. 8,83 D. 9,83
Câu 13: pH của dung dịch thu được sau khi trộn 40ml dung dịch HCl 0,5M với 60ml dung dịch NaOH 0,5M:
A. 7 B. 1 C. 13 D. 14
Câu 14: Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14 N (99,63%) và 15 N (0,37%). Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.
Câu 15: Cho 100 ml dung dịch NH 4 Cl 1M tác dụng với NaOH dư, đun nóng. Sau phản ứng thu được V lít khí NH 3 (đkc). Giá trị của V là:
A. 2,479. B. 3,7185. C. 4,958. D. 7,437.
II. Tự luận (4 điểm)
Câu 1: Methanol và propanoic acid phản ứng với nhau tạo thành methy propanoate theo phản ứng hóa học sau: \(C{H_3}OH(l) + {C_2}{H_5}COOH(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {C_2}{H_5}COOC{H_3}(l) + {H_2}O(l)\)
Ở 50 0 C, giá trị K C của phản ứng trên là 7,5. Nếu cho 11,5 g methanol phản ứng với 37,0 g propanoic acid ở 50 0 C thì khối lượng của methy propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu?
Câu 2: Hỗn hợp A gồm N 2 và H 2 theo tỷ lệ thể tích 1:3, tạo phản ứng giữa N 2 và H 2 sinh ra NH 3 . Sau phản ứng được hỗn hợp khí B có tỉ khối so với khí A là 10/6. Tính hiệu suất phản ứng trên?
Đề 2
I. Trắc nghiệm (6 điểm)
Câu 1 : Cho cân bằng hóa học sau: \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\) \({\Delta _r}H_{298}^o > 0\)
Thao tác nào sau đây không làm chuyển dịch cân bằng ?
A. Tăng nồng độ I 2 B. Giảm nồng độ HI
C. Giảm thấp nhiệt độ của hệ D. Thay đổi áp suất của hệ
Câu 2 : Cho phản ứng hóa học sau: \(A(g) + 2B(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3C(g)\). Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{P_C^3}}{{{P_A}.P_B^2}}\) B. \({K_C} = \frac{{{{{\rm{[}}A]}^3}}}{{{\rm{[}}B{\rm{]}}.{{{\rm{[}}C{\rm{]}}}^2}}}\)
C. \({K_C} = \frac{{{{{\rm{[}}C{\rm{]}}}^3}}}{{{\rm{[}}A].{{{\rm{[}}B{\rm{]}}}^2}}}\) D. \({K_C} = \frac{{3[C{\rm{]}}}}{{{\rm{[}}A].2[B{\rm{]}}}}\)
Câu 3 : Cho phản ứng hóa học sau: \(F{e_2}{O_3}(s) + 3CO(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2Fe(s) + 3C{O_2}(g)\) \({\Delta _r}H_{298}^o > 0\)
Tác động nào sau đây giúp cân bằng chuyển dịch theo chiều thuận ?
A. Tăng nồng độ của Fe B. Tăng áp suất chung của hệ
C. Thêm Al vào hỗn hợp nóng chảy D. Tăng nhiệt độ của phản ứng
Câu 4: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH 3 có lẫn hơi nước, có thể dẫn khí NH 3 đi qua bình đựng dung dịch H 2 SO 4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH 3 , quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 1. D. 4.
Câu 5 : Để xác định nồng độ của dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,02 M. Để chuẩn độ 5ml dung dịch HCl này cần 10ml dung dịch NaOH. Nồng độ của dung dịch HCl là:
A. 0,05M B. 0,1M C. 0,04M D. 0,02M
Câu 6 : Phương trình điện li nào sau đây không đúng ?
A. \(HCl \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + C{l^ - }\) B. \(C{H_3}COOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CH3CO{O^ - } + {H^ + }\)
C. \({H_3}P{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {H_2}P{O_4}^ - \) D. \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\)
Câu 7: Chất nào sau đây không dẫn điện ?
A. KCl khan B. NaCl nóng chảy C. NaOH loãng D. CH 3 COOH loãng
Câu 8 : Cho các dung dịch axit có cùng nồng độ mol: HNO 3 , HCl, H 2 SO 4 , H 3 PO 4 . Dung dịch có pH lớn nhất là
A. H 2 SO 4 B. HCl C. HNO 3 D. H 3 PO 4
Câu 9 : Trộn V 1 ml dung dịch NaOH có pH = 13 với V 2 ml dung dịch Ba(OH) 2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V 1 : V 2 có giá trị là
A. 1 : 1 B. 2 : 1 C. 1 : 10 D. 10 : 1
Câu 10 : Theo thuyết Bronste – lowry chất nào sau đây là lưỡng tính?
A. Mg 2+ B. NH 3 C. HCO 3 - D. SO 3 2-
Câu 11 : Base liên hợp của các aicd HCOOH, HCl, NH 4 + lần lượt là:
A. HCOO - , Cl - , NH 3 B. COO 2- , Cl - , NH 2 -
C. HCOOH - , Cl - , NH 2 - D. HCOOH - , Cl - , NH 2
Câu 12 : Khối lượng NaOH cần dùng để pha được 10ml dung dịch NaOH có pH =12
A. 4g B. 0,4g C. 0,04g D. 40g
Câu 13 : Số oxi hóa thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là:
A. 0 và +5 B. -3 và 0 C. -3 và +5 D. -2 và +4
Câu 14: Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạp thành sản phẩm là
A. NO B. N 2 O C. NH 3 D. NO 2
Câu 15 : Trong tự nhiên, phản ứng giữa nitrogen và oxygen là khởi đầu cho quá trình tạo và cung cấp loại phân bón nào cho cây?
A. Phân kali B. Phân đạm ammoniua
C. Phân lân D. Phân đạm nitrate
II. Tự Luận (4 điểm)
Câu 1: Trong công nghiệp, khí hydrogen được điều chế như sau:
Cho hơi nước đi qua than nung nóng, thu được hỗn hợp khí CO và H 2 (gọi là khí than ướt):
\(C(s) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}(g)\) \({\Delta _r}H_{298}^0 = 130kJ\) (1)
Trộn khí than ướt với hơi nước, cho hỗn hợp đi qua chất xúc tác Fe 2 O 3 :
\(CO(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} C{O_2}(g) + {H_2}(g)\) \({\Delta _r}H_{298}^o = - 42kJ\)(2)
a) Vận dụng nguyên lí Le Chatelier, hãy cho biết cần tác động yếu tố nhiệt độ như thế nào để các cân bằng (1), (2) chuyển dịch theo chiều thuận.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4-5 lần) so với khí carbon monoxide. Giải thích
c) Nếu tăng áp suất, cân bằng (1), (2) chuyển dịch theo chiều nào? Giải thích.
Câu 2: Cho m gam FeO tác dụng với dung dịch HNO 3 thu được 4,958 lít hỗn hợp khí X gồm một khí màu nâu và một khí hoá nâu trong không khí. Biết tỉ khối của X so với H 2 là 20. Tính m?
Đề 3
I. Trắc nghiệm (6 điểm)
Câu 1 : Cho phản ứng hóa học sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\). Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{\rm{[}}S{O_2}]{\rm{[}}{O_2}]}}\) B. \({K_C} = \sqrt {\frac{{{{{\rm{[}}S{O_3}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}}} \)
C. \(\frac{{2[S{O_3}]}}{{2[S{O_2}]{\rm{[}}{O_2}]}}\) D. \({K_C} = \frac{{{\rm{[}}S{O_3}]}}{{{\rm{[}}S{O_2}]{\rm{[}}{O_2}]}}\)
Câu 2 : Yếu tố nào sau đây luôn không thay đổi sự cân bằng hóa học ?
A. Nhiệt độ B. Áp suất C. Xúc tác D. Nồng độ
Câu 3 : Cho các phản ứng hóa học sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\) (2) \(2N{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {N_2}{O_4}(g)\)
(3) \(PC{l_5}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} PC{l_3}(g) + C{l_2}(g)\) (4) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Câu 4: Khi thay đổi áp suất, số cân bằng hóa học bị dịch chuyển là ?
A. (1), (2), (3), (4) B. (2), (3), (4) C. (1), (2) D. (1), (2), (4)
Câu 5: Cho phản ứng sau: \(COC{l_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + C{l_2}(g)\). Tại trạng thái cân bằng, nếu nồng độ CO và Cl 2 đều bằng 0,15M thì nồng độ COCl 2 là bao nhiêu biết K C = 8,2.10 -2 M ở 900K.
A. 0,54M B. 0,27M C. 0,42M D. 0,12M
Câu 6 : Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
A. NH 3 B. NH 4 + C. NO 3 - D. N 2
Câu 7 : Dãy nào sau đây gồm các chất điện li mạnh ?
A. KOH, NaCl, H 2 CO 3 B. Na 2 S, Mg(OH) 2 , HCl
C. HClO, NaNO 3 , Ca(OH) 2 D. HCl, Fe(NO 3 ) 3 , Ba(OH) 2
Câu 8 : Trong dung dịch HNO 3 0,01 M, nồng độ ion OH - ở 25 0 C là
A. [OH - ] = 10 -14
B. [OH - ] = 10 -12
C. [OH - ] = 10 -2
D. [OH - ] = 10 -10
Câu 9 : Chỉ dùng quỳ tím , có thể nhận biết ba dung dịch riêng biệt nào sau đây ?
A. HCl, NaNO 3 , Ba(OH) 2 B. H 2 SO 4 , HCl, KOH
C. H 2 SO 4 , NaOH, KOH D. Ba(OH) 2 , NaCl, H 2 SO 4
Câu 10: Cho dãy các chất: KAl(SO 4 ) 2 .12H 2 O, C 2 H 5 OH, C 12 H 22 O 11 (saccarozơ), CH 3 COOH, Ca(OH) 2 , CH 3 COONH 4 . Số chất thuộc loại chất điện li là
A. 2 B. 3 C. 4 D. 5
Câu 11 : Vị trí (chu kì, nhóm) của nguyên tố nitrogen trong bảng tuần hoàn là
A. Chu kì 2, nhóm VA B. Chu kì 3, nhóm VA
C. Chu kì 2, nhóm VIA D. Chu kì 3, nhóm IVA
Câu 12 : Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen B. Ammonnia C. Oxygen D. Hydrogen
Câu 13: Trong dung dịch, ammonia thể hiện tính base yếu do
A. phân tử ammonia chứa liên kết cộng hoá trị phân cực và liên kết hydrogen.
B. phân tử ammonia chứa liên kết cộng hoá trị phân cực và liên kết ion.
C. phần lớn các phân tử ammonia kết hợp với nước tạo ra các ion NH 4 + và OH - .
D. một phần nhỏ các phân tử NH 3 kết hợp với ion H + của nước tạo NH 4 + và OH - .
Câu 14 : Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
A. Hồng B. Xanh C. Không màu D. Vàng
Câu 15 : Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hòa trong nước). Hai tác nhân chính gây mưa acid là
A. Cl 2 , HCl B. N 2 , NH 3 C. SO 2 , NO x D. S, H 2 S
II. Tự luận (4 điểm)
Câu 1: Người ta tổng hợp NH 3 theo phương trình phản ứng sau: \({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\). Cho hỗn hợp X gồm H 2 và N 2 vào bình kín trong điều kiện nhiệt độ và xúc tác thích hợp thu được khí Y. Biết tỷ khối của X/H 2 = 3,6 và tỉ khối của Y/H 2 =4
a) Tính % thể tích các khí trong hỗn hợp X
b) Tính hiệu suất của phản ứng
Câu 2: Trộn 100ml dung dịch H 2 SO 4 0,1M vào 100ml dung dịch Ba(OH) 2 0,2M thu được m gam kết tủa.
a) Tính m?
b) Tính pH của dung dịch sau phản ứng.
---Hết---
Đề 4
Câu 1: Cho phản ứng hóa học sau: \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\)Biểu thức nào sau đây mô tả giá trị của K C ?
A. \({K_C} = \frac{{{\rm{[}}2HI]}}{{{\rm{[}}{I_2}]{\rm{[}}{H_2}]}}\) B. \({K_C} = \frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{I_2}]{\rm{[}}{H_2}]}}\) C. \({K_C} = \frac{{{{{\rm{[}}2HI]}^2}}}{{{\rm{[}}{I_2}]{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}}\) D. \({K_C} = \sqrt {\frac{{{{{\rm{[}}HI]}^2}}}{{{\rm{[}}{H_2}]{\rm{[}}{I_2}]}}} \)
Câu 2: Cho các phản ứng hóa học sau:
\(\begin{array}{l}(1){H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\\(2)2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\\(3)2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{O_2}(g)\\(4)C{O_2}(g) + {H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CO(g) + {H_2}O(g)\end{array}\)
Khi tăng áp suất, các cân bằng chuyển dịch theo chiều thuận là
A. (1), (2), (3) B. (2), (3) C. (1), (3), (4) D. (1), (2), (3), (4)
Câu 3: Cho cân bằng hoá học:\(CO(g) + {H_2}O(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2}(g) + C{O_2}(g)\) . Ở 427C, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 427C. Nồng độ CO2 ở trạng thái cân bằng:
A. 1,5M B. 0,074M C. 1M D. 0,83M
Câu 4: Dãy nào dưới đây chỉ gồm chất điện li mạnh ?
A. HBr, Na 2 S, Mg(OH) 2 , Na 2 CO 3 B. HNO 3 , H 2 SO 4 , KOH, K 2 SiO 3
C. H 2 SO 4 , NaOH, NaCl, HF D. Ca(OH) 2 , KOH, CH 3 COOH, NaCl
Câu 5: Trong số các chất sau: HNO 2 , CH 3 COOH, KMnO 4 , C 6 H 6 , HCOOH, HCOOCH 3 , C 6 H 12 O 6 , C 2 H 5 OH, SO 2 , Cl 2 , NaClO, CH 4 , NaOH, H 2 S. Số chất thuộc loại chất điện li là
A. 7 B. 8 C. 9 D. 10
Câu 6: Aspirin là một loại thuốc có thành phần chính là acetylsalicylic acid. Nếu hào tan thuốc này vào nước, người ta xác định được pH của dung dịch tạo thành 2,8. Nồng độ OH- của dung dịch tạo thành là:
A. 10 -2,8 B. 10 -14 C. 10 -11,2 D. 10 -7
Câu 7: Cho phản ứng: \({H_2}S{O_4}(aq) + {H_2}O \to HS{O_4}^ - (aq) + {H_3}{O^ + }\)
Cặp acid – base liên hợp trong phản ứng trên là:
A. H 2 SO 4 và HSO 4 - B. H 2 O và H 3 O +
C. H 2 SO 4 và SO 4 2- ; H 2 O và OH - D. H 2 SO 4 và HSO 4 - ; H 3 O + và H 2 O
Câu 8: Những phát biểu nào dưới đây là đúng?
(a) Để so sánh mức độ acid giữa các dung dịch có thể dựa vào nồng độ: dung dịch acid nào có nồng độ lớn hơn sẽ có tính acid mạnh hơn.
(b) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion H + lớn hơn và pH lớn hơn.
(c) Trong các dung dịch có cùng nồng độ, dung dịch nào có nồng độ ion OH – lớn hơn và pH nhỏ hơn sẽ có tính base lớn hơn.
(d) Trong các dung dịch có cùng nồng độ, dung dịch nào có tính acid mạnh hơn sẽ có nồng độ ion H + lớn hơn và pH nhỏ hơn.
(e) Trong các dung dịch có cùng nồng độ, dung dịch có nồng độ ion H + nhỏ và pH cao sẽ có tính acid yếu hơn.
(g) Trong một dãy các dung dịch có cùng nồng độ được sắp xếp theo tính acid tăng dần thì nồng độ ion OH – sẽ giảm dần và K a tăng dần.
A. 3 B. 4 D. 2 D. 5
Câu 9: Trong công nghiệp, ammonia được sản xuất theo phản ứng pha khí:
\({N_2}(g) + 3{H_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}(g)\)
Cho biết các giá trị năng lượng liên kết E b (Kj.mol -1 ):
|
Liên kết |
N\( \equiv \)N |
H-H |
N-H |
|
E b |
945 |
436 |
386 |
Nhiệt của phản ứng trên là:
A. 1481 Kj B. – 1481 KJ C. 63 KJ D. – 63 KJ
Câu 10: Trong các nhận xét dưới đây về muối ammonium, nhận xét nào đúng?
A. Muối ammonium tồn tại dưới dạng tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả muối ammonium đều dễ tan trong nước, khi tan điện li hoàn toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium phản ứng với dung dịch base đặc, nóng thoát ra chất khí làm quỳ tím ẩm hoá đỏ.
D. Khi nhiệt phân các muối ammonium luôn có khí NH 3 thoát ra.
Câu 11: Cho các phát biểu sau:
(1) Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
(2) Để làm khô khí NH 3 có lẫn hơi nước, có thể dẫn khí NH 3 đi qua bình đựng dung dịch H 2 SO 4 đặc.
(3) Khi cho quỳ tím ẩm vào lọ đựng khí NH 3 , quỳ tím chuyển thành màu đỏ.
(4) Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 1. D. 4.
Câu 12: Cho cân bằng: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H 2 giảm đi. Phát biểu đúng khi nói về cân bằng này
A. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
B. Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Câu 13: Ở nhiệt độ thường, khí N 2 khá trơ về mặt hóa học. Nguyên nhân là do:
A. trong phân tử N 2 có liên kết ba rất bền.
B. trong phân tử N 2 , mỗi nguyên tử nitrogen còn 1 cặp electron chưa tham gia liên kết..
C. nguyên tử nitrogen có độ âm điện kém hơn oxygen.
D. nguyên tử nitrogen có bán kính nhỏ.
Câu 14: Người ta sản xuất khi nitrogen trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH 4 NO 2 bão hoà.
C. Dùng phosphorus để đốt cháy hết oxygen không khí.
D. Cho không khí đi qua bột Cu nung nóng.
Câu 15: Tìm câu SAI trong các phát biểu sau?
A. Nitrogen chỉ có số oxi hóa âm trong những hợp chất với hai nguyên tố O và F.
B. Nguyên tử nitrogen có 5 electron ở lớp ngoài cùng.
C. Nguyên tử nitrogen có 3 electron độc thân.
D. Nguyên tử nitrogen có khả năng tạo ra ba liên kết cộng hóa trị với nguyên tố khác.
II.Tự luận (4 điểm)
Câu 1: Cho 0,5 mol SO 2 và 0,7 mol O 2 vào một bình kín dung tích 1 lít được giữ ở nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO3 trong bình là 0,4 mol. Tính hằng số cân bằng K C của phản ứng tổng hợp SO 3 ở nhiệt độ trên
Câu 2: Quá trình gây mưa acid được hình thành từ phương trình:
4NO 2 + O 2 + 2H 2 O\( \to \)4HNO 3
Lấy V lít hỗn hợp khí NO 2 và O 2 vào bình chứa 1 lít nước thu được dung dịch X. Để xác định nồng độ của dung dịch X, người ta lấy 5ml dung dịch X đem chuẩn độ bằng dung 10ml dung dịch NaOH 0,1M. Tính V (lít) hỗn hợp khí.
Đề 5
I. TRẮC NGHIỆM (6 điểm)
Câu 1: Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi
A. tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. nồng độ của các chất tham gia phản ứng bằng nồng độ của các chất sản phẩm.
C. phản ứng thuận đã kết thúc.
D. phản ứng nghịch đã kết thúc.
Câu 2: Cho cân bằng sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\) \(\Delta H = - 192,5kJ\)
Để tăng hiệu suất của quá trình sản xuất SO 3 , người ta cần
A. giảm nhiệt độ của hệ phản ứng, dùng xúc tác
B. giữ phản ứng ở nhiệt độ thường, giảm áp suất
C. tăng nhiệt độ của hệ phản ứng, dùng xúc tác
D. giảm nhiệt độ và tăng áp suất của hệ phản ứng
Câu 3: Qúa trình tổng hợp NH 3 từ H 2 và N 2 (với xúc tác Al 2 O 3 ) có thể được biểu diễn bằng cân bằng hóa học sau: \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3};\Delta H < 0\)
Người ta thử các cách sau:
(1) tăng áp suất của khí N 2 khi cho vào hệ
(2) tăng áp suất chung của hệ
(3) giảm nhiệt độ của hệ
(4) không dùng chất xúc tác nữa
(5) hóa lỏng NH 3 và đưa ra khỏi hệ
Số cách có thể làm cân bằng chuyển dịch theo chiều thuận là
A. 4 B. 3 C. 2 D. 1
Câu 4: Phát biểu nào sau đây đúng khi nói về sự điện li?
A. Sự điện li là quá trình phân li một chất trong nước thành ion
B. Sự điện li là quá trình hòa tan một chất vào nước tạo thành dung dịch
C. Sự điện li là quá trình phân li một chất dưới tác dụng của dòng điện
D. Sự điện li thực chất là quá trình oxi hóa – khử
Câu 5: Chất nào sau đây không phải chất điện li?
A. KOH B. H 2 S C. HNO 3 D. C 2 H 5 OH
Câu 6: Cho phương trình điện li: \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\). Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH 3 COOH B. H 2 O C. NH 4 + D. OH -
Câu 7: Dung dịch nào sau đây có pH > 7?
A. NaCl B. NaOH C. HNO3 D. H2SO4
Câu 8: Số hiệu nguyên tử của nitrogen là
A. 6 B. 7 C. 8 D. 9
Câu 9: Ứng dụng nào sau đây không phải của nitrogen?
A. Tạo khí quyển trơ (giảm nguy cơ cháy nổ)
B. Tổng hợp ammonia
C. Tác nhân làm lạnh (bảo quản thực phẩm, mẫu vật sinh học…)
D. Sản xuất phân lân
Câu 10: N 2 thể hiện tính khử trong phản ứng với
A. H 2 B. O 2 C. Li D. Mg
Câu 11: Trong ammonia, nitrogen có số oxi hóa là
A. +3 B. -3 C. +4 D. +5
Câu 12: Phát biểu không đúng là
A. Trong điều kiện thường, NH 3 là khí không màu, mùi khai
B. Khí NH 3 nhẹ hơn không khí
C. Phân tử NH 3 chứa các liên kết cộng hóa trị không phân cực
D. Khí NH 3 tan nhiều trong nước
Câu 13: Có các mệnh đề sau
(1) Các muối nitrate đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO 3 - có tính oxi hóa trong môi trường acid.
(3) Khi nhiệt phân muối nitrate rắn ta đều thu được khí NO 2 .
(4) Hầu hết muối nitrate đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
A. (1) và (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Câu 14: Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO 3 và H 2 SO 4 loãng giải phóng khí X (không màu, dễ hóa nâu trong không khí). Khí X là
A. NO B. NO 2 C. N 2 O D. NH 3
Câu 15: Phú dưỡng là hiện tượng
A. Ao, hồ dư quá nhiều các nguyên tố dinh dưỡng
B. Ao, hồ thiếu quá nhiều các nguyên tố dinh dưỡng
C. Ao, hồ dư quá nhiều các nguyên tố kim loại nặng
D. Ao, hồ thiếu quá nhiều các nguyên tố kim loại nặng
II. TỰ LUẬN
Câu 1 (2 điểm): Xét cân bằng trong dung dịch gồm NH 4 Cl 0,10 M và NH 3 0,05 M ở 25 oC
\({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }{\rm{ }}{{\rm{K}}_{\rm{C}}}{\rm{ = 1,74}}{\rm{.1}}{{\rm{0}}^{ - 5}}\)
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Câu 2 (2 điểm): Trộn 100ml dung dịch có pH =1 gồm HCl và HNO 3 với 100ml dung dịch NaOH nồng độ a (M) thu được 200ml dung dịch có pH = 12. Tính giá trị của a(M)
Đề 6
Câu 1: Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N 2 ] = 0,45 (M); [H 2 ] = 0,14 (M); [NH 3 ] = 0,62 (M). Giá trị hằng số cân bằng K C của phản ứng trên gần nhất với
A. 10. B. 311. C. 502. D. 6.
Câu 2: Cho phản ứng hóa học: H 2 (g) + I 2 (g) ⇌ 2HI(g)
Ở 430 o C, hằng số K C = 51,52. Biết nồng độ ban đầu của H 2 và I 2 lần lượt là 1,0 (M) và 3,0 (M). Nồng độ của hydrogen tại thời điểm cân bằng là
A. 2,06 M. B. 0,96 M. C. 2,04 M. D. 0,94 M.
Câu 3: Nhận xét nào sau đây sai ?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn diễn ra theo nhiều hướng và xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch, tại thời điểm tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì phản ứng đạt trạng thái cân bằng.
Câu 4: Cho cân bằng hóa học: CaO(s) + CO 2 (g) ⇌ CaCO 3 (s) ∆ r H < 0
Khi áp suất tăng thì
A. cân bằng chuyển dịch theo chiều thuận. B. cân bằng chuyển dịch theo chiều nghịch.
C. cân bằng không chuyển dịch. D. cân bằng chuyển dịch theo cả hai chiều.
Câu 5: Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
A. 2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g). B. CH 4 (g) + Cl 2 (g) ⇌ CH 3 Cl (g) + HCl(g).
C. PCl 5 (g) ⇌ PCl 3 (g) + Cl 2 (g). D. 2CO(g) + O 2 (g) ⇌ 2CO 2 (g)
Câu 6: Cho các chất sau: nitric acid, hydrofluoric acid, hydrochloric acid, sodium hydroxide, potassium chloride, copper hydroxide, acetic acid. Số chất điện li mạnh là:
A. 2. B. 3. C. 4. D. 1.
Câu 7: Phương trình điện li nào dưới đây sai ?
A. NaCl ⟶ Na + + Cl - . B. HF ⇌ H + + F - .
C. CH 3 COOH ⟶ CH 3 COO - + H + . D. KNO 3 ⟶ K + + NO 3 - .
Câu 8: Dung dịch X chứa các ion sau: 0,10 mol Cl - ; 0,15 mol SO 4 2- ; 0,10 mol Na + và a mol Cu 2+ . Giá trị của a là
A. 0,10. B. 0,05. C. 0.20. D. 0,15.
Câu 9: Cho những mô tả dưới đây nói về ứng dụng của chất nào?
(a) Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
(b) Dạng lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
(c) Sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc,…
A. Sulfur. B. Sulfur dioxide. C. Sulfuric acid. D. Sulfur trioxide.
Câu 10: Khi nhỏ sulfuric acid đặc vào cốc đựng đường mía thì xuất hiện hiện tượng
A. đường bị chuyển thành màu đen.
B. đường bị than hóa và có khí mùi hắc thoát ra khỏi cốc.
C. đường bị than hóa và bị đẩy ra khỏi cốc.
D. đường thị than hóa, bị đẩy ra khỏi cốc và có không màu, không mùi thoát ra.
Câu 11: Khẳng định nào dưới đây là sai khi nói về cân bằng của H 2 SO 4 trong nước (Hình 2.6).
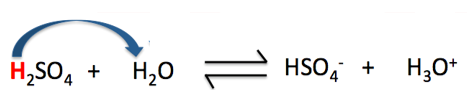
Hình 4.11. Cân bằng của H 2 SO 4 trong nước
A. Trong phản ứng thuận, H 2 SO 4 đóng vai trò là acid.
B. Trong phản ứng thuận, H 2 O đóng vai trò là base.
C. Trong phản ứng nghịch, H 3 O + đóng vai trò là acid.
D. Trong phản ứng thuận, H 2 O là chất cho H + .
Câu 12: Cho các phát biểu:
(a) HCl khi tan trong nước cho dung dịch có pH < 7.
(b) Dãy các chất: HF, NaF, NaOH đều là chất điện li mạnh.
(c) Dãy các chất: C 2 H 5 OH, C 6 H 12 O 6 , CH 3 CHO là các chất điện li yếu.
(d) Những chất khi tan trong nước cho dung dịch dẫn điện được gọi là những chất điện li.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 13: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H + ] của nước chanh là 10 -2,4 mol/L.
C. Nồng độ ion [H + ] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH - ] của nước chanh nhỏ hơn 10 -7 mol/L.
Câu 14: Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là
A. là chất xúc tác cho phản ứng.
B. tạo môi trường trung tính cho phản ứng.
C. làm tăng tốc độ phản ứng.
D. xác định thời điểm khi phản ứng đạt đến hoặc vượt qua điểm tương đương.
Câu 15: Cho 100 ml dung dịch A chứa HCl 0,05M, H 2 SO 4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH) 2 0,02M thu được dung dịch có pH = x. Giá trị x là
A. 1,4. B. 11,8. C. 2,2. D. 12,6.
Câu 16: Thể tích dung dịch Ba(OH) 2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO 3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
A. 0,224 lít. B. 0,15 lít. C. 0,336 lít. D. 0,448 lít.
Câu 17: Hiện tượng mưa acid chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là
A. CO 2 và O 2 . B. NH 3 và HCl. C. SO 2 và NO 2 . D. H 2 S và N 2 .
Câu 18: Phương trình phản ứng nhiệt phân nào sau đây sai ?

Câu 19: Cho hỗn hợp khí A gồm 0,2 mol N 2 ; 0,9 mol H 2 phản ứng trong điều kiện thích hợp thu được hỗn hợp B biết d A/B = 51/55. Hiệu suất phản ứng là
A. 10%. B. 20%. C. 30%. D. 40%.
Câu 20: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO 3 loãng, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam. B. 33,6 gam. C. 44,4 gam. D. 59,2 gam.
Đề 7
Câu 1: Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?
A. Nồng độ của các sản phẩm sẽ không thay đổi vì không còn chất phản ứng.
B. Nồng độ của sản phẩm sẽ không thay đổi vì chất tham gia phản ứng đã hết.
C. Nồng độ của các sản phẩm sẽ không thay đổi vì tốc độ phản ứng thuận và nghịch bằng nhau.
D. Nồng độ của các sản phẩm sẽ thay đổi liên tục do tính thuận nghịch.
Câu 2: Một hỗn hợp cân bằng ở 1500 o C có chứa [N 2 ] = 6,4.10 -3 mol/L; [O 2 ] = 1,7.10 -3 mol/L; [NO] = 1,1.10 -5 mol/L. Phản ứng xảy ra như sau: N 2 (g) + O 2 (g) ⇌ 2NO(g)
Hằng số cân bằng của hệ ở nhiệt độ này là
A. 1,1.10 -5 . B. 1,01.10 -5 . C. 0,98.10 -5 . D. 1,4.10 -5 .
Câu 3: (ID: 646083) Xét cân bằng sau diễn ra trong một piston ở nhiệt độ không đổi:
N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (g)
Nếu nén piston thì cân bằng sẽ chuyển dịch theo chiều nào?
A. Chuyển dịch theo chiều nghịch.
B. Chuyển dịch theo chiều thuận.
C. Có thể chuyển dịch theo chiều thuận hoặc chiều nghịch tuỳ thuộc vào piston bị nén nhanh hay chậm.
D. Không thay đổi.
Câu 4: Khi đun nóng HI trong một bình kín, xảy ra phản ứng sau:
2HI(g) ⇌ H 2 (g) + I 2 (g) ∆H 0 298 > 0
Ở một nhiệt độ xác định, hằng số cân bằng K C của phản ứng bằng \(\frac{1}{{81}}\).
1. Giá trị Kc của phản ứng H 2 (g) + I 2 (g) ⇌ 2HI(g) là
A. 1/81. B. 81. C. 3. D. 1/3.
2. Giá trị Kc của phản ứng HI(g) ⇌ ½ I 2 (g) + ½ H 2 (g) là
A. 1/81. B. 9. C. 81. D. 1/9.
Câu 5: Cho các cân bằng sau:
(1) PCl 3 (s) + Cl 2 (g) ⇌ PCl 5 (s)
(2) CO(g) + H 2 O(g) ⇌ CO 2 (g)+ H 2 (g)
(3) H 2 (g) + I 2 (g) ⇌ 2HI(g)
(4) N 2 (g) + 3H 2 (g) ⇌ 2NH 3 (g)
Các cân bằng không bị chuyển dịch khi chỉ thay đổi áp suất là
A. (1), (3). B. (1), (2), (3), (4). C. (2), (3). D. (2), (4).
Câu 6: Đối với cân bằng H 2 O(l) ⇌ H 2 O(g), điều gì xảy ra nếu tăng áp suất chung của hệ?
A. Nước bốc hơi nhiều hơn. B. Nhiệt độ sôi của nước được tăng lên.
C. Nước bốc hơi ít hơn. D. Không có sự thay đổi.
Câu 7: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường. B. Dung dịch rượu.
C. Dung dịch muối ăn. D. Dung dịch benzene trong alcohol.
Câu 8: Dãy chất nào sau đây khi tan trong nước đều là chất điện li yếu?
A. H 2 S, H 2 SO 3 , H 2 SO 4 . B. H 2 CO 3 , H 3 PO 4 , CH 3 COOH, Ba(OH) 2 .
C. H 2 S, CH 3 COOH, HClO. D. H 2 CO 3 , H 2 SO 3 , HClO, Al 2 (SO 4 ) 3 .
Câu 9: Phương trình điện li nào dưới đây viết không đúng?
A. HCl ⟶ H + + Cl - . B. CH 3 COOH ⇌ CH 3 COO - + H + .
C. HClO ⟶ H + + ClO - . D. Na 3 PO 4 ⟶ 3Na + + PO 3 3-
Câu 10: 200 mL dung dịch X có chứa acid HCl 1 M và NaCl 1 M. Số mol của các ion Na + , Cl-, H + trong dung dịch X lần lượt là
A. 0,2; 0,2; 0,2. B. 0,1; 0,2; 0,1. C. 0,2; 0,4; 0,2. D. 0,1; 0,4; 0,1.
Câu 11: Dung dịch X chứa các ion sau: 0,10 mol Cl - ; 0,15 mol NO 3 - ; 0,15 mol Na + và a mol Cu 2+ . Giá trị của a là
A. 0,10. B. 0,05. C. 0.20. D. 0,15.
Câu 12: Dung dịch nào dưới đây có số mol ion H + lớn nhất? (Biết dung dịch có cùng thể tích)
A. Dung dịch HCl 0,1M. B. Dung dịch H 2 SO 4 0,1M.
C. Dung dịch CH 3 COOH 0,1M. D. Dung dịch HF 0,1M.
Câu 13: Công thức hóa học của nitrogen dioxide là
A. NO. B. NO 2 C. N 2 O. D. N 2 O 4 .
Câu 14: Nguyên nhân nào dưới đây không phải là nguồn gốc sinh ra các oxide của nitrogen?
A. Cháy rừng. B. Khí thải xe cộ. C. Mưa giông. D. Quá trình quang hợp.
Câu 15: Mưa acid thường có độ pH như thế nào?
A. pH = 7. B. pH < 3. C. pH < 5,6. D. pH > 9,6.
Câu 16: Kim loại nào dưới đây không tan trong dung dịch nitric acid?
A. Mg. B. Cu. C. Ag. D. Au.
Câu 17: Hòa tan hoàn toàn kim loại iron trong dung dịch nitric acid dư. Sau phản ứng thu được dung dịch chưa muối X và khí Y không màu hóa nâu ngoài không khí. Vậy X và Y lần lượt là
A. Fe(NO 3 ) 3 và NO 2 . B. Fe(NO 3 ) 2 và NO. C. Fe(NO 3 ) 3 và NO. D. Fe(NO 3 ) 2 và NO 2 .
Câu 18: Hỗn hợp X gồm Fe và Cu. Hòa tan hoàn toàn 15,2 gam X bằng dung dịch HNO 3 loãng dư, sau phản ứng thu được 4,958(L) NO (ở đkc, sản phẩm khử duy nhất). Khối lượng muối khan thu được có giá trị gần nhất với
A. 50. B. 52. C. 55. D. 58.
Câu 19: Chỉ dung thêm H 2 SO 4 có thể phân biệt dãy các chất nào dưới đây?
A. K 2 CO 3 , BaCl 2 , NaCl, Na 2 S. B. KCl, Ba(NO 3 ) 2 , NaNO 3 , Na 2 SO 4 .
C. NaCl, NaNO 3 , BaCl 2 , Na 2 CO 3 . D. HCl, HNO 3 . Ba(OH) 2 , NaOH.
Câu 20: Cho lần lượt các chất sau: FeS, Fe 3 O 4 , FeO, Fe 2 O 3 , FeCO 3 , Fe(OH) 3 tác dụng với dung dịch H 2 SO 4 đặc nóng. Số phản ứng oxi hóa – khử là
A. 2. B. 3. C. 4. D. 5.
----- HẾT -----