Đề thi học kì 1 Hóa 11 Chân trời sáng tạo - Đề số 7
Chất nào dưới đây không là chất điện li?
Đề bài
Chất nào dưới đây không là chất điện li?
-
A.
CH 3 COOH.
-
B.
HNO 3 .
-
C.
NaCl.
-
D.
CaCO 3 .
Dãy chất nào sau đây khi tan trong nước đều là chất điện li mạnh?
-
A.
H 2 SO 4 , Cu(NO 3 ) 2 , CaCl 2 , H 2 S.
-
B.
HCl, H 3 PO 4 , Fe(NO 3 ) 3 , NaOH.
-
C.
HNO 3 , CH 3 COOH, BaCl 2 , KOH.
-
D.
H 2 SO 4 , MgCl 2 , Al 2 (SO 4 ) 3 , Ba(OH) 2 .
Cho 0,4 mol SO 2 và 0,6 mol O 2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO 3 trong bình là 0,3 mol. Giá trị hằng số cân bằng K C của phản ứng ở nhiệt độ trên là
-
A.
6,67.
-
B.
20.
-
C.
0,05.
-
D.
10.
Cho 2 mol CH 3 COOH vào 1 mol CH 3 OH xảy ra phản ứng:
CH 3 COOH(l) + CH 3 OH(l) ⇌ CH 3 COOCH 3 (l) + H 2 O(l)
Biết tại điểm cân bằng ở 25 o C , phản ứng có K C = 2. Hiệu suất của phản ứng là
-
A.
38,2%.
-
B.
61,8%.
-
C.
76,4%.
-
D.
23,6%.
Dung dịch nào dưới đây có pH < 7?
-
A.
NaHCO 3 .
-
B.
NaCl.
-
C.
HCl.
-
D.
CuSO 4 .
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,25M. Để chuẩn độ 20 ml dung dịch HCl này cần dùng hết 10 ml dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên?
-
A.
0,25M.
-
B.
0,5M.
-
C.
0,125M.
-
D.
0,05M.
Hiện tượng xả ra khi để hai ống nghiệm chứa lần lượt dung dịch HCl và dung dịch NH 3 đặc gần nhau là
-
A.
xuất hiện khói trắng.
-
B.
xuất hiện khói vàng.
-
C.
xuất hiện khói màu đen.
-
D.
xuất hiện khói màu nâu.
Khi iron (sắt) phản ứng với nitric acid với nồng độ khác nhau, hàm lượng sản phẩm khử với nồng độ nitric acid được thể hiện trong hình sau
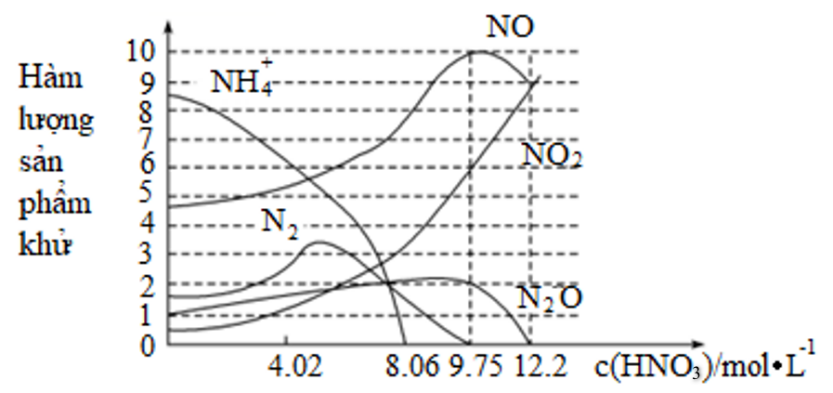
Phát biểu nào sau đây là sai ?
-
A.
Ở nồng độ nitric acid thấp, hàm lượng sản phẩm khử là NH 4 + cao.
-
B.
Khi nồng độ nitric acid là 9,75 thì sản phẩm khử chỉ là NO.
-
C.
Nồng độ nitric acid càng cao, thì trạng thái oxi hoá của N trong sản phẩm khử càng cao.
-
D.
Khi nồng động nitric acid là 12,2 mol/L, sản phẩm khử là NO và NO 2 có tỉ lệ mol 1 : 1.
Cho các phát biểu về nitrogen như sau:
(a) Trong hợp chất, các số oxi hóa thường gặp của nguyên tử nitrogen là -3, 0, +4, +5.
(b) Khí nitrogen kém hoạt động hóa học ở nhiệt độ thường.
(c) Nitrogen là phi kim tương đối hoạt động ở nhiệt độ cao.
(d) Trong tự nhiên, nitrogen chỉ tồn tại ở dạng đơn chất.
(e) Nitrogen là chất khí, không màu, tan ít trong nước.
Số phát biểu đúng là
-
A.
3.
-
B.
2.
-
C.
5.
-
D.
4.
Phản ứng nào dưới đây hydrogen sulfide thể hiện tính khử?
-
A.
H 2 S + 2NaOH ⟶ Na 2 S + 2H 2 O.
-
B.
H 2 S + NaOH ⟶ NaHS + H 2 O.
-
C.
H 2 S + CuCl 2 ⟶ CuS + 2HCl.
-
D.
H 2 S + 4I 2 + 4H 2 O ⟶ H 2 SO 4 + 8HI.
Hầu hết các kim loại được tìm thấy dưới dạng quặng trên bề mặt Trái đất và trải qua nhiều quá trình để tách được kim loại ra khỏi quặng. Quặng nào dưới đây không tạo thành sulfur dioxide khi nung trong lò cao?
-
A.
Pyrite.
-
B.
Thạch cao.
-
C.
Chalcopyrite.
-
D.
Chu sa.
Khí thải có chứa NO 2 góp phần gây ra mưa acid và hiện tượng phú dưỡng. Đâu là giải thích đúng cho hiện tượng trên?
-
A.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm giảm độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen ngăn cản quá trình phú dưỡng diễn ra.
-
B.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm giảm độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen thúc đẩy quá trình phú dưỡng diễn ra nhanh.
-
C.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm tăng độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen ngăn cản quá trình phú dưỡng diễn ra.
-
D.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm tăng độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen thúc đẩy quá trình phú dưỡng diễn ra nhanh.
Phương pháp chưng cất dựa trên nguyên tắc
-
A.
chất rắn tách ra từ dung dịch bão hòa của chất đó khi thay đổi điều kiện hòa tan (dung môi, nhiệt độ).
-
B.
sự phân bố khác nhau trong hai môi trường không hòa tan vào nhau.
-
C.
dựa vào sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở một áp suất nhất định.
-
D.
dựa trên sự phân bố khác nhau của các chất giữa hai pha động và pha tĩnh.
Cho các tính chất sau:
(1) xảy ra chậm, không hoàn toàn.
(2) xảy ra nhanh, hoàn toàn.
(3) thường xảy ra theo nhiều hướng khác nhau.
(4) thường xảy ra theo một hướng xác định.
(5) thường sinh ra một sản phẩm duy nhất.
(6) thường sinh ra hỗn hợp sản phẩm.
Các tính chất thuộc về phản ứng hữu cơ là
-
A.
(1), (4), (5).
-
B.
(1), (3), (6).
-
C.
(2), (4), (6).
-
D.
(2), (3), (5).
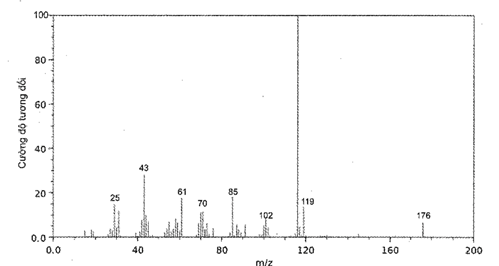
Phân tử hexanoic acid có phổ khối lượng (MS) như hình vẽ dưới đây:

Phân tử khối của hexanoic acid là
-
A.
60
-
B.
110
-
C.
87
-
D.
71
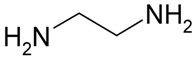
-
A.
CHN 2 .
-
B.
C 2 H 6 N 2 .
-
C.
C 2 H 5 N 2 .
-
D.
C 2 H 8 N 2 .
Cặp chất nào sau đây là đồng phân của nhau?
-
A.
CH 3 -CH=CH-CH 2 -OH và C 4 H 9 -OH.
-
B.
CH 3 -O-CH 3 và CH 3 CHO.
-
C.
CH 3 -CH(OH)-CH 3 và CH 3 -O-CH 2 -CH 3 .
-
D.
CH 2 =CH 2 và CH 2 =CH-CH 3 .
-
A.
119.
-
B.
176.
-
C.
118.
-
D.
200.
Chất hữu cơ X có phân tử khối 123 amu, và khối lượng C, H, O và N trong phân tử theo thứ tự tỉ lệ với 72 : 5 : 32 : 4. Công thức phân tử của X là
-
A.
C 6 H 14 O 2 N.
-
B.
C 6 H 6 ON 2 .
-
C.
C 6 H 12 ON.
-
D.
C 6 H 5 O 2 N.
Đốt cháy hoàn toàn 9,0 gam hợp chất hữu cơ A (chứa C, H, O) thu được 7,437 lít CO 2 (đkc) và 5,4 gam H 2 O. Công thức phân tử của hợp chất A là (biết tỉ khối hỏi của A so với oxygen bằng 1,875)
-
A.
CH 2 O.
-
B.
CHO.
-
C.
C 2 H 4 O 2 .
-
D.
C 4 H 8 O 4 .
Lời giải và đáp án
Chất nào dưới đây không là chất điện li?
-
A.
CH 3 COOH.
-
B.
HNO 3 .
-
C.
NaCl.
-
D.
CaCO 3 .
Đáp án : D
Nhận biết chất điện li.
Chất không điện li: CaCO 3 .
Dãy chất nào sau đây khi tan trong nước đều là chất điện li mạnh?
-
A.
H 2 SO 4 , Cu(NO 3 ) 2 , CaCl 2 , H 2 S.
-
B.
HCl, H 3 PO 4 , Fe(NO 3 ) 3 , NaOH.
-
C.
HNO 3 , CH 3 COOH, BaCl 2 , KOH.
-
D.
H 2 SO 4 , MgCl 2 , Al 2 (SO 4 ) 3 , Ba(OH) 2 .
Đáp án : D
Dựa vào lý thuyết về sự điện li.
H 2 SO 4 , MgCl 2 , Al 2 (SO 4 ) 3 , Ba(OH) 2 khi tan trong nước đều là chất điện li mạnh.
Cho 0,4 mol SO 2 và 0,6 mol O 2 vào một bình dung tích 1 lít được giữ ở một nhiệt độ không đổi. Phản ứng trong bình xảy ra như sau:
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g)
Khi phản ứng đạt đến trạng thái cân bằng, lượng SO 3 trong bình là 0,3 mol. Giá trị hằng số cân bằng K C của phản ứng ở nhiệt độ trên là
-
A.
6,67.
-
B.
20.
-
C.
0,05.
-
D.
10.
Đáp án : B
Kiến thức về hằng số cân bằng của phản ứng.
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g)
Ban đầu: 0,4 0,6
Phản ứng: 0,3 ⟵ 0,15 ⟵ 0,3
Sau: 0,1 0,45 0,3
\({K_C} = \frac{{{{{\rm{[}}S{O_2}]}^2}}}{{{{{\rm{[}}S{O_2}]}^2}{\rm{[}}{O_2}]}} = \frac{{0,{3^2}}}{{0,{1^2}.0,45}} = 20\)
Cho 2 mol CH 3 COOH vào 1 mol CH 3 OH xảy ra phản ứng:
CH 3 COOH(l) + CH 3 OH(l) ⇌ CH 3 COOCH 3 (l) + H 2 O(l)
Biết tại điểm cân bằng ở 25 o C , phản ứng có K C = 2. Hiệu suất của phản ứng là
-
A.
38,2%.
-
B.
61,8%.
-
C.
76,4%.
-
D.
23,6%.
Đáp án : C
Sử dụng công thức tính hằng số cân bằng để tìm lượng chất phản ứng.
CH 3 COOH(l) + CH 3 OH(l) ⇌ CH 3 COOCH 3 (l) + H 2 O(l)
Ban đầu: 2 1
Phản ứng: x ⟶ x ⟶ x ⟶ x
Cân bằng: 2 – x 1 – x x ⟶ x
\({K_C} = \frac{{x.x}}{{(2 - x).(1 - x)}} = 2\)⟹ x = 0,764
H% = 0,764/1.100% = 76,4%
Dung dịch nào dưới đây có pH < 7?
-
A.
NaHCO 3 .
-
B.
NaCl.
-
C.
HCl.
-
D.
CuSO 4 .
Đáp án : C
Dung dịch có pH < 7 ⟶ dung dịch có môi trường acid.
Dung dịch có môi trường acid: HCl.
Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,25M. Để chuẩn độ 20 ml dung dịch HCl này cần dùng hết 10 ml dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên?
-
A.
0,25M.
-
B.
0,5M.
-
C.
0,125M.
-
D.
0,05M.
Đáp án : C
Dựa vào phương pháp chuẩn độ.
HCl + NaOH ⟶ NaCl + H 2 O
C M HCl .V HCl = C M NaOH .V NaOH
⟹ C M HCl .20 = 0,25.10
⟹ C M HCl = 0,125 M
Hiện tượng xả ra khi để hai ống nghiệm chứa lần lượt dung dịch HCl và dung dịch NH 3 đặc gần nhau là
-
A.
xuất hiện khói trắng.
-
B.
xuất hiện khói vàng.
-
C.
xuất hiện khói màu đen.
-
D.
xuất hiện khói màu nâu.
Đáp án : A
Lý thuyết về tính chất hóa học của ammonia.
HCl + NH 3 ⟶ NH 4 Cl trắng
Khi iron (sắt) phản ứng với nitric acid với nồng độ khác nhau, hàm lượng sản phẩm khử với nồng độ nitric acid được thể hiện trong hình sau

Phát biểu nào sau đây là sai ?
-
A.
Ở nồng độ nitric acid thấp, hàm lượng sản phẩm khử là NH 4 + cao.
-
B.
Khi nồng độ nitric acid là 9,75 thì sản phẩm khử chỉ là NO.
-
C.
Nồng độ nitric acid càng cao, thì trạng thái oxi hoá của N trong sản phẩm khử càng cao.
-
D.
Khi nồng động nitric acid là 12,2 mol/L, sản phẩm khử là NO và NO 2 có tỉ lệ mol 1 : 1.
Đáp án : B
Kiến thức về HNO 3 và phương pháp xử lí đồ thị.
B sai, vì khi nồng độ nitric acid là 9,75 thì sản phẩm gồm: N 2 O, NO, NO 2 .
Cho các phát biểu về nitrogen như sau:
(a) Trong hợp chất, các số oxi hóa thường gặp của nguyên tử nitrogen là -3, 0, +4, +5.
(b) Khí nitrogen kém hoạt động hóa học ở nhiệt độ thường.
(c) Nitrogen là phi kim tương đối hoạt động ở nhiệt độ cao.
(d) Trong tự nhiên, nitrogen chỉ tồn tại ở dạng đơn chất.
(e) Nitrogen là chất khí, không màu, tan ít trong nước.
Số phát biểu đúng là
-
A.
3.
-
B.
2.
-
C.
5.
-
D.
4.
Đáp án : A
Dựa vào lí thuyết về nitrogen
(a) sai , vì nitrogen có số oxi hóa bằng 0 khi tồn tại ở dạng đơn chất N 2 .
(b), (c), (e) đúng .
(d) sai , vì trong tự nhiên nitrogen tồn tại ở cả đơn chất và hợp chất.
Phản ứng nào dưới đây hydrogen sulfide thể hiện tính khử?
-
A.
H 2 S + 2NaOH ⟶ Na 2 S + 2H 2 O.
-
B.
H 2 S + NaOH ⟶ NaHS + H 2 O.
-
C.
H 2 S + CuCl 2 ⟶ CuS + 2HCl.
-
D.
H 2 S + 4I 2 + 4H 2 O ⟶ H 2 SO 4 + 8HI.
Đáp án : D
Lý thuyết về tính chất hóa học của H 2 S.
Phản ứng nào dưới đây hydrogen sulfide thể hiện tính khử: H 2 S + 4I 2 + 4H 2 O ⟶ H 2 SO 4 + 8HI.
Hầu hết các kim loại được tìm thấy dưới dạng quặng trên bề mặt Trái đất và trải qua nhiều quá trình để tách được kim loại ra khỏi quặng. Quặng nào dưới đây không tạo thành sulfur dioxide khi nung trong lò cao?
-
A.
Pyrite.
-
B.
Thạch cao.
-
C.
Chalcopyrite.
-
D.
Chu sa.
Đáp án : B
Kiến thức về điều chế sulfur dioxide.
Quặng pyrite: 2FeS 2 + 11/2O 2 \( \to \) Fe 2 O 3 + 4SO 2 .
Quặng chalcopyrite: 2CuFeS 2 + 13/2O 2 \( \to \) 2CuO + Fe 2 O 3 + 4SO 2
Chu sa: HgS + 3/2O 2 \( \to \) HgO + SO 2
Khí thải có chứa NO 2 góp phần gây ra mưa acid và hiện tượng phú dưỡng. Đâu là giải thích đúng cho hiện tượng trên?
-
A.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm giảm độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen ngăn cản quá trình phú dưỡng diễn ra.
-
B.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm giảm độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen thúc đẩy quá trình phú dưỡng diễn ra nhanh.
-
C.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm tăng độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen ngăn cản quá trình phú dưỡng diễn ra.
-
D.
Khí NO 2 hòa tan vào nước mưa tạo thành acid, làm tăng độ pH của nước mưa gây hiện tượng mưa acid. Đồng thời N 2 O có thành phần nitrogen thúc đẩy quá trình phú dưỡng diễn ra nhanh.
Đáp án : B
Kiến thức về hiện tượng phú dưỡng.
Khi đó, khí NO 2 ngoài môi trường được hòa tan trong nước mưa sẽ hình thành HNO 3 , những hạt acid được hòa lẫn vào nước mưa, làm cho nước mưa có độ pH giảm gây hiện tượng mưa acid.
NO 2 có thành phần nitrogen thúc đẩy quá trình phú dưỡng diễn ra nhanh.
Phương pháp chưng cất dựa trên nguyên tắc
-
A.
chất rắn tách ra từ dung dịch bão hòa của chất đó khi thay đổi điều kiện hòa tan (dung môi, nhiệt độ).
-
B.
sự phân bố khác nhau trong hai môi trường không hòa tan vào nhau.
-
C.
dựa vào sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở một áp suất nhất định.
-
D.
dựa trên sự phân bố khác nhau của các chất giữa hai pha động và pha tĩnh.
Đáp án : C
Lý thuyết về phương pháp chưng cất.
Phương pháp chưng cất dựa trên nguyên tắc dựa vào sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở một áp suất nhất định.
Cho các tính chất sau:
(1) xảy ra chậm, không hoàn toàn.
(2) xảy ra nhanh, hoàn toàn.
(3) thường xảy ra theo nhiều hướng khác nhau.
(4) thường xảy ra theo một hướng xác định.
(5) thường sinh ra một sản phẩm duy nhất.
(6) thường sinh ra hỗn hợp sản phẩm.
Các tính chất thuộc về phản ứng hữu cơ là
-
A.
(1), (4), (5).
-
B.
(1), (3), (6).
-
C.
(2), (4), (6).
-
D.
(2), (3), (5).
Đáp án : B
Dựa vào đặc điểm của phản ứng hữu cơ.
Các đặc điểm của phản ứng hữu cơ:
(1) xảy ra chậm, không hoàn toàn.
(3) thường xảy ra theo nhiều hướng khác nhau.
(6) thường sinh ra hỗn hợp sản phẩm.
Phân tử hexanoic acid có phổ khối lượng (MS) như hình vẽ dưới đây:

Phân tử khối của hexanoic acid là
-
A.
60
-
B.
110
-
C.
87
-
D.
71
Đáp án : B
Phân tích dữ liệu phổ MS.
Phân tử khối của hexanoic acid là 110.
Chọn B.
-
A.
CHN 2 .
-
B.
C 2 H 6 N 2 .
-
C.
C 2 H 5 N 2 .
-
D.
C 2 H 8 N 2 .
Đáp án : D
Xác định công thức phân tử từ công thức cấu tạo rút gọn.
Công thức phân tử là C 2 H 8 N 2 .
Chọn D.
Cặp chất nào sau đây là đồng phân của nhau?
-
A.
CH 3 -CH=CH-CH 2 -OH và C 4 H 9 -OH.
-
B.
CH 3 -O-CH 3 và CH 3 CHO.
-
C.
CH 3 -CH(OH)-CH 3 và CH 3 -O-CH 2 -CH 3 .
-
D.
CH 2 =CH 2 và CH 2 =CH-CH 3 .
Đáp án : C
Đồng phân là những hợp chất hữu cơ có cùng công thức phân tử.
CH 3 -CH(OH)-CH 3 và C 3 H 7 -OH có cùng công thức phân tử C 3 H 8 O.
Chọn C.
-
A.
119.
-
B.
176.
-
C.
118.
-
D.
200.
Đáp án : B
Phân tích dữ liệu phổ MS.
Phân tử khối của vitamin C là 176.
Chọn B.
Chất hữu cơ X có phân tử khối 123 amu, và khối lượng C, H, O và N trong phân tử theo thứ tự tỉ lệ với 72 : 5 : 32 : 4. Công thức phân tử của X là
-
A.
C 6 H 14 O 2 N.
-
B.
C 6 H 6 ON 2 .
-
C.
C 6 H 12 ON.
-
D.
C 6 H 5 O 2 N.
Đáp án : D
Xác định công thức phân tử.
C : H : O : N =\(\frac{{72}}{{12}}:\frac{5}{1}:\frac{{32}}{{16}}:\frac{{14}}{{14}}\) = 6 : 5 : 2 : 1
CTPT: (C 6 H 5 O 2 N) n
123n = 123 ⟶ n = 1
CTPT: C 6 H 5 O 2 N.
Chọn D.
Đốt cháy hoàn toàn 9,0 gam hợp chất hữu cơ A (chứa C, H, O) thu được 7,437 lít CO 2 (đkc) và 5,4 gam H 2 O. Công thức phân tử của hợp chất A là (biết tỉ khối hỏi của A so với oxygen bằng 1,875)
-
A.
CH 2 O.
-
B.
CHO.
-
C.
C 2 H 4 O 2 .
-
D.
C 4 H 8 O 4 .
Đáp án : C
Xác định công thức phân tử từ phản ứng đốt cháy.
n CO2 = 0,3 (mol) ⟶ n C = 0,3 (mol) ⟶ m C = 3,6 (g)
n H2O = 0,3 (mol) ⟶ n H = 0,6 (mol) ⟶ m H = 0,6 (g)
⟹ m O = 4,2 (g) ⟶ n O = 0,3 (mol)
Cách 1:
C : H : O = 0,3 : 0,6 : 0,3 = 1 : 2 : 1
⟶ CTPT: (CH 2 O) n
M A = 1,875.32 = 60
30n = 60 ⟶ n = 2
CTPT: C 2 H 4 O 2 .
Cách 2:
M A = 60 ⟶ n A = 9/60 = 0,15 (mol)
C = n C /n A = 2
H = n H /n A = 4
O = n O /n A = 2
⟶ CTPT: C 2 H 4 O 2
Chọn C.