Bài 20. Ôn tập chương 6 trang 101, 102 Hóa 10 Kết nối tri thức
Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm? Cho khoảng 2 g zinc dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây ( các điều kiện khác giữ nguyên)
Bài tập 1
|
Câu 1. Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm? (a) Đốt cháy nhiên liệu. (b) Sắt bị gỉ. (c) Trung hòa acid - base |
Phương pháp giải:
Phản ứng xảy ra nhanh hay chậm phụ thuộc vào nhiều yếu tố: trạng thái tồn tại, nồng độ, nhiệt độ, áp suất,…
Lời giải chi tiết:
(a) Phản ứng xảy ra nhanh.
(b) Phản ứng xảy ra chậm
(c) Phản ứng xảy ra nhanh.
Bài tập 2
|
Câu 2. Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H 2 SO 4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)? (a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều. (b) Thay dung dịch H 2 SO 4 2 M bằng dung dịch H 2 SO 4 1M có cùng thể tích. (c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 o C). |
Phương pháp giải:
- Tốc độ phản ứng tăng khi: tăng diện tích tiếp xúc, tăng nồng độ, tăng nhiệt độ…
Lời giải chi tiết:
(a) Kẽm được dùng dưới dạng bột nên tăng diện tích tiếp xúc
=> Tốc độ phản ứng tăng lên
(b) Dung dịch H 2 SO 4 1M có nồng độ giảm so với ban đầu H 2 SO 4 2M
=> Tốc độ phản ứng giảm xuống
(c) Tăng nhiệt độ của phản ứng
=> Tốc độ phản ứng tăng lên
Bài tập 3
|
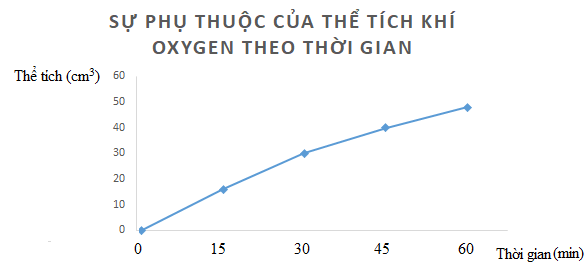
Câu 3. Hydrogen peroxide phân hủy theo phản ứng: 2H 2 O 2 → 2H 2 O + O 2 . Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian. b) Tính tốc độ trung bình của phản ứng ( theo cm 3 /min) trong khoảng thời gian: - Từ 0 – 15 phút - Từ 15 – 30 phút - Từ 30 – 45 phút - Từ 45 – 60 phút Nhận xét sự thay đổi tốc độ trung bình theo thời gian. |
Phương pháp giải:
Lời giải chi tiết:
a)
b)

Nhận xét: Tốc độ trung bình giảm dần theo thời gian
Bài tập 4
|
Câu 4. Hãy thiết kế một thí nghiệm để chứng minh ảnh hưởng của nhiệt độ đến tốc độ phản ứng của zinc và sulfuric acid loãng. |
Phương pháp giải:
Nhiệt độ tăng lên, tốc độ phản ứng cũng tăng.
Lời giải chi tiết:
Chuẩn bị: 2 ống nghiệm, 2 kẹp gỗ, 1 đèn cồn, 4 gam Zn hạt và dung dịch H 2 SO 4 loãng 0,1 M.
Tiến hành:
- Cho vào 2 ống nghiệm, mỗi ống 5mL H 2 SO 4 0,1M
- Cho cùng một lượng (2 gam) zinc dạng viên vào ống nghiệm (1) và (2).
- Đun nóng 1 ống nghiệm
Kết quả: Ống nghiệm dược đun nóng sẽ thoát khí nhanh hơn.
Bài tập 5
|
Câu 5. Một phản ứng ở 45 o C có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van’t Hoff của phản ứng bằng 2. |
Phương pháp giải:
\(\gamma = \frac{{{v_{T + 10}}}}{{{v_T}}}\)
Lời giải chi tiết:
\(\gamma = \frac{{{v_{T + 10}}}}{{{v_T}}}\)
=> \(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{{T_2} - {T_1}}}{{10}}}}\)
Ta có: v1 = 0,068 v2 = 0,017 T1 = 45 o C
=> \(\frac{{0,017}}{{0,068}} = {2^{\frac{{x - 45}}{{10}}}}\)
=> x = 25 o C